
Стандартизация 0,1 М раствора сульфата церия(IV) по
раствору тиосульфата натрия с известным КП (способ пипетирования)
2 Ce(SO4)2 + 4 KI = Ce2(SO4)3 + 2 K2SO4 + I2
I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6
Методика: В склянку с притёртой пробкой вместимостью 250 см3 помещают 20 см3 раствора сульфата церия(IV), добавляют 10 см3 раствора серной кислоты (1:9), 0,5 г Na2CO3, 3 г KI, быстро закрывают склянку пробкой, перемешивают и оставляют стоять 10 минут. Затем обмывают пробку водой и титруют выделившийся йод 0,1 М раствором тиосульфата натрия до соломенно-жёлтой окраски раствора, добавляют 2 см3 раствора крахмала и продолжают медленно титровать при тщательном перемешивании до обесцвечивания раствора.
Параллельно проводят «холостой опыт», для чего к 20 см3 воды добавляют 10 см3 раствора серной кислоты (1:9), 0,5 г Na2CO3, 3 г KI и титруют, как описано выше.
КП 0,1 М Ce(SO4)2 рассчитывают по формуле:
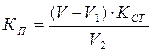 ; где:
; где:
V - объём 0,1 М раствора тиосульфата натрия, израсходованного на титрование раствора сульфата церия;
V1 - объём 0,1 М раствора тиосульфата натрия, израсходованного на «холостое» титрование;
Kст - коэффициент поправки 0,1 М раствора тиосульфата натрия;
V2 - объём 0,1 М раствора сульфата церия, взятый для титрования.
Дата добавления: 2015-07-21; просмотров: 111 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Перманганатометрия. | | | Потенциометрия. |