
|
Читайте также: |
Атомы углерода, имея среднее значение ЭО, примерно в одинаковой степени склонны и отдавать, и присоединять электроны. Поэтому простые вещества С (в частности, графит) обладают соответственно как восстановительными, так и окислительными свойствами.
Окисляются графитом, в основном, металлы. При этом продукты реакций со ЩМ и ЩЗМ являются карбидами с ионной решеткой (как, например, Na4C или Ca2C). А соединения C с d-металлами (в частности, Fe3C) относятся к веществам с ковалентной координационной решеткой. Окисляются графитом (но в жестких условиях) также кремний (продукт – карборунд SiC) и водород.
При взаимодействии с остальными неметаллами как С, так и, тем более, Si являются восстановителями. Однако при об.у. они инертны: реагируют лишь со фтором (образуя ЭF4), а с другими веществами – только при высокой температуре. Так, при сильном нагревании кремний окисляется (до +4) даже азотом (давая Si3N4), серой (SiS2) и т.п.
Графит в раскаленном состоянии вступает в реакцию с серой (получается CS2), а также с хлором (продукт CCl4) и с парами воды. Но даже при нагревании графит не взаимодействует с растворами щелочей и разбавленными кислотами, а окисляется лишь концентрированными H2SO4 и HNO3 (до CO2).
Алмаз еще более пассивен: загорается на воздухе выше 900°С, в то время как графит – при 700°С. Для сгорания кремния нужен меньший нагрев (600°С); и в щелочах Si (в отличие от графита) растворяется:
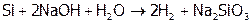 .
.
Однако к кислотам кремний более устойчив: на него действует только смесь концентрированных HNO3 и HF:
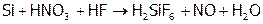 .
.
Эти кислоты как бы объединяют свои «усилия»: HNO3 окисляет Si до Si4+, точнее до SiO2, а HF растворяет SiO2, образуя фторокремниевую кислоту H2SiF6. И только при таком двойном действии кислот кремний реагирует с ними. Поэтому добавки его к металлам (в частности, к железу) повышают их кислотостойкость..
Метан
Метан СН4 (бесцветный газ) можно синтезировать по реакции, используя кроме нагрева еще и катализатор (Ni):
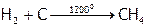 .
.
Однако на практике метан выделяют из природных газов (содержащих 60-90% СН4), что гораздо дешевле.
Природные газы – это, например, рудничные, а также болотные. (Они получаются при разложении останков растений и животных в отсутствии кислорода.) Входит СН4 и в состав коксового газа (образующегося при нагревании угля без доступа воздуха). Во многих странах действуют установки получения метана анаэробной тепловой (40-60°С) переработкой отходов животноводства. При этом одновременно гибнут болезнетворные микробы и исчезает неприятный запах навоза; таким образом, он превращается в безвредное и очень ценное удобрение для полей.
Молекула СН4 является тетраэдром (sp3-гибридизация орбиталей углерода), т.е. симметричной частицей, поэтому (несмотря на полярность связей) неполярной. Как следствие, метан имеет низкую температуру сжижения (–162°С), практически не растворяется в воде и при об.у. химически достаточно инертен – не взаимодействует с растворами кислот и щелочей.
Однако его смеси с воздухом взрывоопасны, что часто бывает причиной несчастных случаев на угольных шахтах. Используется метан, в основном, как топливо, а также для получения водорода реакцией с парами воды (второй продукт – СО).
Дата добавления: 2015-07-25; просмотров: 59 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Структура и физические свойства простых веществ | | | Общая характеристика и свойства |