
Читайте также:
|
В данном опыте определяют порядок реакции разложения тиосерной кислоты:

Тиосерная кислота является неустойчивым соединением, поэтому ее получают в эксперименте при взаимодействии тиосульфата натрия и серной кислоты:
 .
.
Начальная концентрация тиосерной кислоты 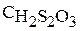 соответствует исходной концентрации тиосульфата натрия с учетом увеличения объема реакционной смеси за счет добавления воды и серной кислоты.
соответствует исходной концентрации тиосульфата натрия с учетом увеличения объема реакционной смеси за счет добавления воды и серной кислоты.
Средняя скорость реакции разложения тиосерной кислоты рассчитывается по формуле:
 .
.
За ходом протекания реакции наблюдают по плотности суспензии серы, образующейся при разложении тиосерной кислоты. Достигаемая визуально во всех опытах одинаковая плотность суспензии соответствует одинаковому количеству разложившейся кислоты. Следовательно,  во всех проводимых опытах – постоянная величина. Вследствие этого при графическом определении порядка реакции средняя скорость разложения тиосерной кислоты можно быть рассчитана по формуле:
во всех проводимых опытах – постоянная величина. Вследствие этого при графическом определении порядка реакции средняя скорость разложения тиосерной кислоты можно быть рассчитана по формуле:
 .
.
В химический стакан из бюретки налейте 10 мл 0,3 М раствора тиосульфата натрия и 30 мл воды. В пробирку налейте 10 мл 0,25 М раствора серной кислоты. Одновременно слейте растворы серной кислоты и тиосульфата натрия. Отметьте время с момента сливания растворов до появления коллоидных частиц серы – помутнения раствора. Аналогично проделайте опыты с увеличивающимися концентрациями тиосульфата натрия, изменив пропорции тиосульфата натрия и воды согласно табл. 8. Результаты опыта занесите в табл. 8.
Таблица 8
Температура опыта – …ºС
| Опыт | Объем растворов, мл |  моль/л моль/л
| 
|  , с , с
|  , с–1 , с–1
| |||

| 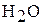
| 
| общий объем, мл | |||||
| – |
Расчет
1. На основании полученных данных постройте график зависимости  от логарифма концентрации тиосерной кислоты
от логарифма концентрации тиосерной кислоты  при постоянной температуре.
при постоянной температуре.
2. Определите по графику порядок реакции разложения тиосерной кислоты.
3. Напишите кинетическое уравнение реакции разложения тиосерной кислоты.
3. На основании графика сделайте вывод о зависимости скорости химической реакции от концентрации реагирующих веществ. Согласуются ли ваши наблюдения с законом действующих масс?
Дата добавления: 2015-07-25; просмотров: 475 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №1. Определение константы скорости, порядка и времени полураспада реакции разложения пероксида водорода | | | Опыт №3. Зависимость скорости реакции от температуры. Определение энергии активации разложения тиосерной кислоты |