
Читайте также:
|
10.
Фенол С6Н5ОН – бесцветное, кристаллическое вещество с характерным запахом. Его t плавления = 40,9 С. В холодной воде он мало растворим, но уже при 70◦С растворяется в любых отношениях. Фенол ядовит. В феноле гидроксильная группа соединена с бензольным кольцом.
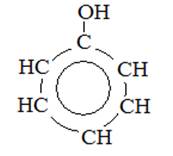
Химические свойства
1. Взаимодействие с щелочными металллами.
2C6H5OH + 2Na → 2C6H5ONa + H2
фенолят натрия
2. Взаимодействие со щелочью (фенол – слабая кислота)
C6H5OH + NaOH → C6H5ONa + H2O
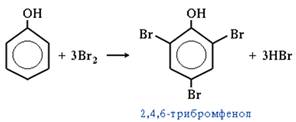
3. Галогенирование.
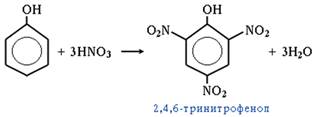
4. Нитрование
5. Качественная реакция на фенол
3C6H5OH +FeCl3 → (C6H5O)3Fe +3HCl (фиолетовое окрашивание)
Применение
Разбавленные водные растворы фенола (карболка (5%)) применяют для дезинфекции помещений, белья. Широко используется в молекулярной биологии и генной инженерии для очистки ДНК. В смеси с хлороформом ранее использовался для выделения ДНК из клетки.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин, а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества),
11.
ПРОСТЫЕ ЭФИРЫ – класс органических соединений, содержащих фрагмент R–O–R', в котором две органические группы соединены атомом кислорода. Прилагательное «простые» в названии эфиров помогает отличить их от другого класса соединений, именуемого сложными эфирами.
Применение простых эфиров
В медицине серный эфир применяют для наркоза.
Анизол С6Н5ОСН3 (рис. 4) и ФЕНЕТОЛ С6Н5ОС2Н5 (рис. 3) используют в качестве лекарств и душистых веществ.
12.
Альдеги́ды (от лат. al cohol dehyd rogenatus — спирт, лишённый водорода) — класс органических соединений, содержащих альдегидную группу (–CHO). ИЮПАК определяет альдегиды как вещества вида R-CHO, в которых карбонильная группа связана с одним атомом водорода и одной группой R.
Физические свойства альдегидов
Формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды до С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом, являются твёрдыми веществами.
Вязкость, плотность и показатель преломления при 20 °C увеличиваются с увеличением молярной массы альдегидов. Низшие альдегиды являются подвижными жидкостями, а альдегиды от гептаналя до ундеканаля имеют маслообразную консистенцию.
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при 20 °С составляет лишь 0,6 % по массе. Алифатические альдегиды растворимы в спиртах, простых эфирах и других распространённых органических растворителях.
Низшие альдегиды имеют резкий запах, а высшие гомологи (С8-С13) являются компонентами многих парфюмерных изделий.
Химические свойства[править | править вики-текст]
Высокая реакционная способность связана с наличием полярной связи С=О. Альдегиды являются жёсткими основаниями Льюиса и, в соответствии с этим, атом кислорода в них может координироваться с жёсткими кислотами: H+, ZnCl2, BF3, AlCl3 и т. д. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе.
Применение альдегидов.
Из альдегидов наибольшее применение имеет формальдегид. Особенности применения формальдегида: используется обычно в виде водного раствора – формалина; многие способы применения формальдегида основаны на свойстве свертывать белки; формалин применяется также для сохранения биологических препаратов; при взаимодействии формальдегида с аммиаком получается широко известное лекарственное вещество уротропин.
13.
Одноосновные предельные карбоновые кислоты (одноосновные насыщенные карбоновые кислоты) — карбоновые кислоты, в которых насыщенныйуглеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу СnH2n+1COOH Физические свойства
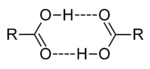
Димеры карбоновых кислот
Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом. Кислоты с большим количеством атомов углерода — твёрдые вещества, нерастворимые в воде. Плотность муравьиной и уксусной кислот больше единицы, остальных — меньше. Температура кипения возрастает по мере увеличения молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят при более высокой температуре, чем кислоты изостроения.
У кислот нормального строения есть закономерность: температура плавления кислот с чётным числом атомных углеродов выше, чем температура плавления соседних с нечётным числом. Это объясняется расположением метильной и карбоксильной групп — в кислотах чётного ряда они по разные стороны от оси молекулы, а нечётного — по разные. Благодаря более симметричному строению молекулы кислоты с чётным числом атомов углерода сильнее взаимодействуют между собой в кристаллической решётке и её труднее разрушить при нагревании.
Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты. Их молекулы ассоциированы намного сильнее вследствие того что связи 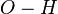 в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу 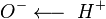 . Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом состоянии карбоновые кислоты существуют в основном в виде циклических димеров[2][5], а в жидком происходит и линейная ассоциация[7]. Даже в парах они димеризированы[6]. Две водородные связи довольно прочны, энергия димеризации для муравьиной кислоты составляет 14 ккал/моль.
. Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом состоянии карбоновые кислоты существуют в основном в виде циклических димеров[2][5], а в жидком происходит и линейная ассоциация[7]. Даже в парах они димеризированы[6]. Две водородные связи довольно прочны, энергия димеризации для муравьиной кислоты составляет 14 ккал/моль.
Химические свойства (20 мин)
КИСЛОТНЫЕ СВОЙСТВА
1. Отщепление протона водорода от кислоты говорит о том, что уксусная кислота в растворах диссоциирует на ионы: СН 3– COOH ↔ СН 3– COO - + H + и образующийся ион водорода придает раствору кислую среду.
Опыт: (Слайд 12) П + 1 мл раствора уксусной кислоты + 1-2 капли раствора метилоранжевого.
Что наблюдаете? Уравнение записать в таблицу.
2. Взаимодействие с металлами.
R – COOH + Me → R – COOMe + H 2↑
Давайте рассмотрим данное свойство на опыте. (Слайд 13)
Пробирка + 1 мл раствора уксусной кислоты + чуть-чуть металлического магния.
Что вы наблюдаете? Какой газ выделяется? Запишите результаты в таблицу.
Один из учащихся составляет уравнение данной реакции на доске:
| 2 СН 3– COOH + Mg → | (CH 3– COO)2 Mg | + H 2↑ |
| Ацетат магния |
3. Взаимодействие с основными оксидами и основаниями. (Слайд 14)
R – COOH + MeО → R – COOMe + H 2 О
R – COOH + MeОН → R – COOMe + H 2 О
Рассмотрим на опыте взаимодействие уксусной кислоты с гидроАксидом натрия.
П + 1 мл раствора гидроксида натрия + 1 капля раствора фенолфталеина + 1-2 мл раствора уксусной кислоты.
Что вы наблюдаете?
Один из учащихся составляет уравнение данной реакции на доске:
| СН 3– COOH + NaOH → | CH 3– COONa | + H 2 О |
| Ацетат натрия |
4. Взаимодействие с солями более слабых кислот. (Слайд 15)
Опыт: П + 2 мл раствора уксусной кислоты + 1 мл раствора карбоната натрия.
Что наблюдаете? (Результаты в таблицу)
Один из учащихся составляет уравнение данной реакции на доске:
| 2 СН 3– COOH + Na 2 СО 3 → | 2 CH 3– COONa | + СО 2↑ + H 2 О |
| Ацетат натрия |
Учитель: Все данные свойства являются общими химическими свойствами для всех кислот, как органических, так и неорганических. Но карбоновые кислоты, как представители органических соединений, обладают и особыми свойствами, так называемыми – специфическими.
Замещение Н может протекать не только в функциональной группе, но и в радикале.
5. Галогенирование (замещение идет в а-положении).
| СН 3– COOH + Cl – Cl → | СН 2 Cl – COOH | + HCl |
| 2-хлоруксусная кислота |
6. Замещение группы – ОН.
Реакция этерификации - образование сложных эфиров (при нагревании в присутствии серной кислоты).
| С 3 Н 7– COOH + СН 3– CH 2 OH ↔ | С 3 Н 7– COOСН 2 СН 3 | + H 2 О |
| Этилбутанат (фруктовый запах) |
Опыт: (Слайд 16) П + 1 мл раствора уксусной кислоты + 1 мл раствора этилового спирта + 2-3 капли концентрированной серной кислоты. Пробирку закрепить в держателе и осторожно нагревать в течении минуты. Спиртовку затушить колпачком. Осторожно жидкость понюхать.
Что вам напоминает образующийся запах?
Учитель: Данная реакция нашла очень широкое применение в промышленности. На основе получения сложных эфиров в косметической и парфюмерной промышленности ученые создают разнообразные запахи и ароматы, которые так нас привлекают.
(Слайды 17-21)
Учащиеся, под руководством учителя, делают выводы по практической части.
Химические свойства к/кислот разнообразны, они:
· диссоциируют в растворах (электролиты);
· одноосновные карбоновые кислоты способны вступать в реакции замещения как по радикалу, так и по функциональной группе;
· вступают в реакции этерификации, которые имеют широкое значение в промышленности.
Применение
Карбоновые кислоты — исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов — сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот — пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы — компоненты лаков и пластмассы. Амиды кислот — эмульгаторы и флотоагенты.
14.
Дата добавления: 2015-07-11; просмотров: 94 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Графический дизайн форм | | | Двухосновные карбоновые кислоты (дикарбоновые кислоты) |