
Читайте также:
|
Электрическая проводимость и ЭДС
(разделы кафедрального задачника
по химической термодинамике)
Составитель: Беляев Б.А.
2005 г.
Концентрация и активность ионов
в растворах электролитов
В качестве основной концентрационной характеристики растворов электролитов используется моляльная концентрация m, или моляльность, показывающая какое количество вещества электролита содержится в 1 кг растворителя:
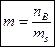 , ,
| (1.1) |
где nB – количество вещества электролита, моль;
ms – масса растворителя, кг.
Для ненасыщенных растворов и неизотермических условий применение моляльной концентрации предпочтительнее использования молярной концентрации, поскольку моляльность не зависит от температуры и от изменения объема раствора.
Процессы диссоциации в растворах электролитов лучше учитываются при введении средней ионной моляльности m±, связь которой с моляльной концентрацией m электролита выражается уравнением:
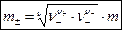 , ,
| (1.2) |
где n+ и n– – количество катионов и количество анионов в формульной единице электролита 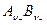 соответственно; n = n+ + n– – общее количество ионов в формульной единице электролита
соответственно; n = n+ + n– – общее количество ионов в формульной единице электролита 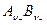 .
.
Важной характеристикой электролитов является ионная сила раствора I, связанная с концентрациями ионов следующей формулой:
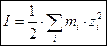 , ,
| (1.3) |
где mi – моляльность i -го иона в растворе, моль/кг растворителя;
zi – зарядовое число i -го иона, безразмерная величина.
Средняя ионная активность a± определяется по формуле:
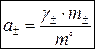 , ,
| (1.4) |
где g± – средний ионный моляльный коэффициент активности, безразмерная величина; m° – стандартная моляльность, m° = 1 моль/кг растворителя.
Общая активность a электролита связана со средней ионной активностью a± следующим соотношением:
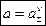 , ,
| (1.5) |
где n – общее количество ионов в формульной единице электролита.
Из определений а и a± следует, что обе эти величины безразмерные.
Задание 1
Для водного раствора сильного электролита по данным табл. 1 рассчитайте следующие величины:
1) ионную силу I на основе моляльности;
2) среднюю ионную моляльность m ±;
3) среднюю ионную активность a ±;
4) общую активность электролита a.
Таблица 1. Исходные данные к заданию 1.
| № вари- анта | Электролит | m, моль/кг воды | № вари- анта | Электролит | m, моль/кг воды |
| CaCl2 | 1,0 | Co(NO3)2 | 3,0 | ||
| Ca(NO3)2 | 2,0 | K3[Fe(CN)6] | 1,0 | ||
| KI | 1,5 | H2SO4 | 15,0 | ||
| AlCl3 | 0,7 | KOH | 10,0 | ||
| LaCl3 | 2,0 | HCl | 15,0 | ||
| SnCl2 | 0,1 | FeCl2 | 1,5 | ||
| Na2SO4 | 0,4 | MgCl2 | 3,0 | ||
| UO2(ClO4)2 | 5,0 | Pb(NO3)2 | 1,0 | ||
| Al2(SO4)3 | 1,0 | HClO4 | 16,0 | ||
| NaH2PO4 | 1,0 | LiCl | 20,0 | ||
| AgNO3 | 3,0 | NaOH | 20,0 | ||
| NaF | 0,8 | NiSO4 | 2,0 | ||
| Cr2(SO4)3 | 1,0 | NH4NO3 | 20,0 | ||
| ZnBr2 | 20,0 | HNO3 | 3,0 |
Дата добавления: 2015-07-10; просмотров: 442 | Нарушение авторских прав