
|
Читайте также: |
Диазокетоны 1а,б и 2а,б имеют в УФ спектрах несколько интенсивных полос поглощения в районе 230-350нм, а также более слабую полосу в области 400 нм (табл. 2). На основании обычных критериев отнесения полос поглощения определенным электронным переходам (интенсивность полосы поглощения, смещение в “синюю” или “красную” области спектра при переходе от неполярного к полярному растворителю [48]) можно с определенной долей уверенности сделать отнесение n - π * переходам только длинноволновых полос поглощения диазокетонов 1а,б и 2а,б, наблюдаемых в области 391-414 нм. У этих слабых полос при переходе от неполярного гексана к полярным растворителям (ТГФ, МеОН. СН3СN) наблюдается значительный синий сдвиг полосы поглощения в коротковолновую область спектра (на 10-22 нм, табл. 2).
Таблица 2. Характеристики УФ спектров диазокетонов 1а,б и 2а,б
| Диазокетон №№ | Гексан | ТГФ | Метанол | Ацетонитрил | ||||
| 1а | λмакс, нм | lgε | λмакс, нм | lgε | λмакс, нм | lgε | λмакс, нм | lgε |
| 4.21 | 4.28 | 4.17 | 4.11 | |||||
| 2.85 | 2.93 | 3.25 | 3.1 | |||||
| 1.46 | 1.49 | 1.54 | 1.46 | |||||
| 2а | 4.45 | 4.26 | 4.26 | 4.07 | ||||
| 3.22 | 3.37 | 3.5 | 3.27 | |||||
| 1.43 | 1.48 | 1.56 | 1.28 | |||||
| 1б | 4.22 | |||||||
| 4.17 | 4.2 | 4.34 | 4.38 | |||||
| 3.83 | 282*) | 3.78 | 4.18 | 4.08 | ||||
| 3.35 | 305*) | 3.26 | 298*) | 3.43 | 303*) | 3.13 | ||
| 1.53 | 1.56 | 1.57 | 1.46 | |||||
| 2б | 3.57 | 4.37 | ||||||
| 3.52 | 4.32 | |||||||
| 307*) | 2.41 | 307*) | 3.42 | |||||
| 0.4 | 1.32 |
*) Перегиб на кривой поглощения
Что же касается полос в области 230-350 нм, которые, очевидно, являются суперпозицией полос поглощения диазокарбонильного фрагмента молекулы [49] иароматических ядер [48], то сделать их отнесение определенным электроннымпереходам на основании имеющихся данных в настоящее время не представляется возможным.
Фотолиз диазокетонов изучали на примере пары региоизомерных диазосоединений 1а, 2а (R = F). Для выяснения основных направлений фотолиза, на данном этапе исследования УФ облучение проводили полным светом ртутной лампы среднего давления «Hanau S-81» (100-130 вт) через кварцевый фильтр (λ > 210 нм, т.н. “коротковолновый” фотолиз) без какой-либо дополнительной монохроматизации излучения лампы. Фотохимическую реакцию проводили при температуре 15-20 оС в растворе тетрагидрофурана с добавлением 20-ти эквивалентов МеОН (по отношению к диазокетону) до исчезновения диазокетонов 1а, 2а в реакционной смеси (по данным ТСХ). Продолжительность облучения в этих условиях обычно составляла 3 часа. По окончании фотолиза растворитель и другие легколетучие компоненты отгоняли полностью в вакууме, остаток разделяли на колонке с силикагелем и таким образом определяли препаративные выходы полученных соединений (см. схемы 10, 11 и экспериментальную часть).
Для количественной оценки воспроизводимости полученных результатов каждый фотолиз повторяли еще два раза в аналитическом варианте с меньшим количеством исходных диазокетонов (100-120 мг). После обычной обработки реакционной смеси в этих опытах содержание продуктов реакции определяли методом внутреннего стандарта с N-метилмалеимидом. Структуру выделенных веществ устанавливали с помощью спектров ЯМР 1Н и 13С, а также сопоставлением полученных данных с известными характеристиками их аналогов, полученных при изучении фотохимических превращений региоизомерных диазокетонов 1в, 2в (R = Н) [46]. Структура, некоторые спектральные характеристики и выходы полученных соединений в различных условиях фотолиза приведены на схемах 9, 10 и в экспериментальной части. Молекулярная структура ключевого продукта фотолиза – гидразона 9 по данным РСА приведена на рис. 3.

Рис. 3. Молекулярная структура продукта С-Н-внедрения 9в по данным РСА.
Как видно из полученных данных (Схема 9) в результате фотолиза диазокетона 1а в растворе ТГФ/МеОН в течение 3-х часов образуются четыре продукта реакции – 8, 9а, 10а, 4. Основными из них являются метиловый эфир оксетанкарбоновой кислоты 8 (41%) и замещенный гидразон 9а (15%), который формально, как уже отмечалось выше, можно рассматривать как продукт внедрения терминального атома азота диазогруппы в α -СН связь тетрагидрофурана. Наряду с этими соединениями в реакционной смеси были идентифицированы также продукты 1,2-миграции арильной группы 10а и монокетон 4.
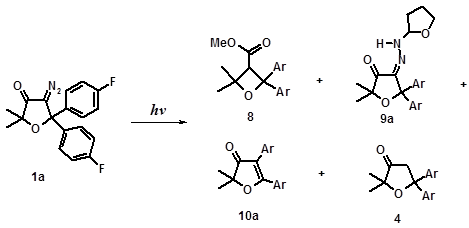
| Условия фотолиза | Выходы, % *) | |||
| 9а | 10а | |||
| ТГФ/MeOH, 3 ч | 41 (33) | 15 (14) | ||
| ТГФ/MeOH, 1,5 ч | ||||
| ТГФ/MeOH, 3 ч; O2 |
*) В скобках приведены препаративные выходы продуктов фотолиза
Схема 9. Фотолиз диазокетона 1а
При сокращении времени облучения диазокетона 1а в два раза (с 3-х до полутора часов) выход продукта внедрения 9а увеличивается почти в два раза (с 15 до 28%) при небольшом уменьшении выхода метилового эфира 8 (п. Вольфа) (на 5-6%), тогда как выходы остальных продуктов реакции остаются практически неизменными. По-видимому, гидразон 9а фотохимически нестабилен и в условиях коротковолнового облучения реакционной смеси претерпевает дальнейшие фотохимические превращения.
Фотолиз диазокетона 1а в тех же условиях (ТГФ/МеОН, 3 часа), но в присутствии кислорода приводит к увеличению почти в два раза выхода продукта внедрения 9а при одновременном уменьшении на 9% выхода продукта перегруппировки Вольфа 8. Что касается других продуктов реакции 10а и 4, то их выходы при этом фактически не изменяются (Схема 9).
Результаты фотохимической реакции изомерного диазокетона 2а с двумя геминальными арильными заместителями при α -карбонильной группе оказался практически идентичным фотолизу региоизомера 1а. В результате этого фотохимического превращения тоже образуются четыре продукта реакции, имеющие аналогичную структуру, примерно те же выходы и соотношение, что и при фотолизе диазокетона 1а (Схема 10).

*) В скобках приведены препаративные выходы продуктов фотолиза
Схема 10. Фотолиз диазокетона 2а
Таким образом, можно заключить, что при коротковолновом немонохроматическом облучении региоизомерные диазокетоны 1а, 2а претерпевают практически одни и те же фотохимические превращения, и в этих условиях фотолиза различия в их структуре практически не сказываются на направлении и соотношении наблюдаемых фотопроцессов. Это заключение вполне согласуется с данными расчетов энергии первого возбужденного состояния S1, сделанного на основании характеристик самой длинноволновой полосы поглощения в УФ спектрах региоизомерных диазокетонов 1а и 2а (413-414 нм; табл. 2). Согласно расчетным данным энергия возбужденного состояния S1 у этих диазокетонов примерно одинакова и составляет 69 и 71 ккал/моль соответственно.
Дата добавления: 2015-10-21; просмотров: 62 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Изучение спектральных характеристик изомерных диазокетонов 1а-в, 2а-в | | | Исполнитель обязуется |