
|
Читайте также: |
Количественное определение
АРГЕНТОМЕТРИЯ
Аргентометрический метод основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
MeHal + AgNO3 → AgHal↓+ MeNO3
F  (ЛВ)=1
(ЛВ)=1
Метод является фармакопейным и используется в экспресс-анализе
Для количественного определения натрия и калия галогенидов в ЛП используются варианты метода:
Вариант Мора (прямое титрование ); индикатор - калия хромат.
Среда – нейтральная или слабо-щелочная рН=7,0 – 10,0.
Натрия хлорид, калия хлорид, натрия бромид, калия бромид.
NaCI + AgNO3 → AgCI↓ + NaNO3
NaBr + AgNO3 → AgBr↓+ NaNO3
Реакция индикации: 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3
коричневато- красный,
оранжево-красный
(оранжево-желтый ГФ Х)
Осадок Ag2CrO4↓образуется только при полном осаждении хлорид и бромид-ионов, т.к. растворимость его больше растворимости AgCI↓ и AgBr↓.
Роль рН среды:
А) В кислой среде рН<7 не работает индикатор, т.к. в кислой среде хромат-ион CrO42-переходит в дихроматCr2O72 и индикаторными свойствами не обладает вследствие высокой растворимостиAg2Cr2O7-(равновесие реакции диссоциации CrO42- смещено вправо)
2CrO4 + 2H+ ↔ 2HCrO4 - ↔ Cr2O72- + Н2O
Б) В щелочной среде рН>10 не работает титрант, т.к. образуется осадок AgOH, который распадается на оксид Ag2O и воду
AgNO3 +OH-→ AgOH↓ + NO3-
2 AgOH→ Ag2O + H2O
Натрия йодид и калия йодид методом Мора не определяют, т.к.
1) йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты),
2) окраска осадков серебра йодида и серебра хромата близка по цвету.
Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛB слабо-основного характера (например, натрия бензоат), создающих слабощелочную реакцию среды.
Вариант Фаянса (прямое титрование). Титрант: раствор серебра нитрата.
Индикаторы - адсорбционные (натрия эозинат, бромфеноловый синий, флюоресциин). Среда разведенной уксусной кислоты необходима, т.к. индикаторы являются слабыми протолитами, а при титровании в уксусной кислоте преобладает ионная форма индикатора. Изменение окраски в т.э. происходит за счет адсорбционных процессов, протекающих на поверхности осадка AgI.
Натрия йодид, калия йодид; Титрант: раствор серебра нитрата.
индикатор - натрия эозинат. Среда - уксуснокислая (разбавленная CH3COOH).
а) NaInd ←→ Ind- + Na+
Эозинат натрия
б ) NaI + AgNO3 → AgI↓ + NaNO3
в) Ind- + AgI↓ + AgNO3 → [(AgI)Ag+]Ind-↓ + NO3-
Изб.капля Розовый осадок
В процессе титрования 0,1н AgNO3 идет осаждение иодид-ионов с образованием коллоидного осадка AgI. Частицы осадка йодида серебра до т.э. будут адсорбировать на своей поверхности вследствие химического сродства одноименные иод-ионы I-. Будет формироваться коллоидная частица
AgI · nI- · n К+
Ионы индикатора в этот момент не адсорбируются, а остаются в растворе.
В т.э. после полного осаждения йод-ионовI- в избытке Аg+ осадок будет адсорбировать Аg+ и знак заряда частиц осадка будет меняться на положительный
AgI·nAg+
Ионная форма индикатора с отрицательным зарядом будет притягиваться положительным зарядом коллоидной частицы и образовывать окрашенное адсорбционное соединение
AgI·nAg+·nInd- (от розового в растворе до розового на осадке).
Т.о. титрование заканчивается при образовании розового осадка.
На точность фиксации т.э. влияет:
1) величина рН. Адсорбционные индикаторы являются слабыми протолитами, поэтому титрование при определенном значении рН в уксуснокислой среде
2) концентрация раствора. С ↑ площади поверхности осадка - ↑ количество адсорбированных молекул индикатора и более резкое изменение окраски в т.э. При увеличении концентрации иодид-ионов в растворе повышается точность.
3) посторонние ионы. Адсорбционные индикаторы чувствительны к значению ионизации посторонних ионов в растворе. Это учитывается при определении йодидов в многокомпонентных смесях.
Вариант Фаянса может быть применен для определения хлоридов и бромидов. В качестве индикаторов используются бромфеноловый синий или флуоресцеин. Используют для определения НCI и НBr азотистых оснований (новокаин - прокаин).
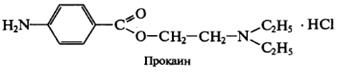
Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности.
R ∙ НС1 + AgNO3 → AgCl↓ + R· HNO3
Фольгарда (обратное титрование). Галогены осаждаются избытком титранта серебра нитрата. Не вступивший в реакцию осаждения серебра нитрат, оттитровывается р-ром тиоцианата аммония, индикатор - железоаммонийные квасцы.
NaCI +AgNO3(избыток) → AgCI↓ + NaNO3
AgNO3(остаок) +NH4SCN →AgSCN↓ +NH4NO3
Реакция индикации
NH4SCN +NH4Fe(SO4)2· 12H2O → Fe(SCN)3 +(NH4)2SO4 + 12H2O
красное окр.
Вариант Кольтгофа (прямое титрование).
Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaCI, KCI, CaCl2, NaBr, KBr).Титрант: раствор серебра нитрата.
Индикатор: йодкрахмальный - 1 капля раствора калия йодата (0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания.
Уравнение индикации
KIO3 + 5KI + 3H2SO4→3I2 + 3K2SO4 + ЗН2O
I2 + KI + крахмал <-> синее окрашивание
По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом:
KI + AgNO3 → Agl↓+ KNO3
В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора.
Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПРAgI = 1,5 • 10-16; ПР AgBr = 4,4 • 10-13; ПР AgCI = 1,8· 10-10).
Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат - дорогостоящий реактив, поэтому метод не экономичен.
2. Меркуриметрический метод. Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (П). Применяют для всех галогенидов натрия и калия.
Титранты - легко ионизированные соли ртути (II): ртути (II) нитрат -Hg(NO3)2, ртути (II) перхлорат - Hg(CIO4)2. Среда: азотнокислая.
Индикатор: дифенилкарбазон.
2MeHal + Hg(NO3)2 → HgHal2 + 2MeN03
F  (MeHaL)=1
(MeHaL)=1

Светло-сиреневое окрашивание.
Йодиды натрия и калия титруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов.
Титрант: ртути (И) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2]
2KI + Hg(ClO4)2→ HgI2 + 2КСlO4
Спирт: вода (1:1)
F  (ЛВ)=1
(ЛВ)=1
3. Броматометрический метод. Используется в анализе йодидов калия и натрия.
Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида:
6KI + KBrO3 + 6HCI → 3I2 + 6КС1 + KBr + ЗН2O
3I2 + KBrO3 + 6HCI → 6ICI + KBr + ЗН2O
Суммарное уравнение:
6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6Н2O
Уравнение после сокращения коэффициентов:
3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3Н2O
F  (MeI)=1/2 I
(MeI)=1/2 I  -2ē → I+
-2ē → I+
Дата добавления: 2015-10-16; просмотров: 635 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Пошаговые уроки рисования пейзажа. Рисование пейзажа. | | | ПОМИЛКИ |