
|
Читайте также: |
В органической химии широко применяется частное определение окислительно-восстановительных процессов. Восстановлением называется процесс отнятия кислорода, присоединение водорода или одновременно отщепление кислорода и присоединение водорода. Под окислением понимают реакции противоположного направления.
В практике чаще всего подвергают восстановлению нитрогруппу (-NО2) и гораздо реже нитрозо (-NО), азо- (-N=N-), циано- (-СN) и другие группы. Поэтому мы остановимся главным образом на восстановлении нитросоединений.
Реакция восстановления ароматических нитросоединений в аминосоединения была открыта в 1842 году знаменитым русским химиком Н. Н. Зининым. Он получил анилин восстановлением нитробензола сернистым аммонием в спиртовой среде. Работы Н. Н. Зинина сделали ароматические амины доступными для практики.
Восстановление нитросоединений до аминопроизводных можно осуществить каталитически с помощью молекулярного водорода:
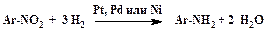
| (1) |
На практике по сию пору широко используются процессы химического восстановления нитросоединений. Уравнения реакций этого типа более сложны, чем уравнение (1). Однако при их составлении необходимо иметь в виду, что количество восстановителя, необходимое для получения амина, должно быть эквивалентно количеству водорода в уравнении (1).
Течение процесса восстановления и его результаты сильно зависят от концентрации ионов Н+ и ОН- в реакционной массе, а также от природы восстановителя. Наиболее распространенные методы восстановления можно объединить в основные группы:
1. Восстановление металлами в присутствии растворов электролитов.
2. Восстановление металлами в кислой среде.
3. Восстановление металлами в щелочной среде.
4. Восстановление молекулярным водородом на катализаторах
Восстановление металлами в присутствии
растворов электролитов
Восстановление железом в присутствии электролитов является широко применимым на практике методом восстановления нитросоединений. Для его проведения в качестве восстановителя употребляют чугунные опилки – отходы металлообрабатывающих заводов. В качестве электролитов чаще всего применяют соли железа: хлористое железо, уксуснокислое железо, а также хлористый аммоний и др.
Электролиты вводят в реакционный аппарат готовыми или (чаще) получают в самом аппарате при нагревании чугунных стружек с разбавленной соляной, уксусной или серной кислотой. Процесс приготовления электролита называется “протравлением железа” и производится перед добавлением нитросоединения. После приготовления электролита в реакционный аппарат добавляют порциями при нагревании нитросоединение.
Химическая неоднородность чугуна является причиной его электрохимического окисления во влажной среде, так как обуславливает возможность возникновения элементарных гальванических пар. Присутствие электролита усиливает коррозию металла вследствие увеличенной проводимости раствора электролита по сравнению с водой. В результате электрохимического окисления железа освобождаются электроны, которые расходуются на восстановление нитросоединения. Железо превращается в смесь оксидов: закись-окись железа Fe3O4 или иную смесь из FeO и Fe2O3.
| 3 Fe + 4 H2O ¾¾® Fe3O4 + 8 H+ + 8 е- | (2) |
| Ar-NO2 + 4 H2O ¾¾® Ar-NH2 + 6 H+ - 6 е- | (3) |
Комбинируя реакции (2, 3), получим суммарное уравнение реакции окисления-восстановления:
| 4 Ar-NO2 + 9 Fe + 4 H2O ¾¾® 4 Ar-NH2 + 3 Fe3O4 | (4) |
Электролит при восстановлении не расходуется и его количества, равного 0,1 – 0,2 моля на моль нитросоединения, бывает достаточно для протекания реакции.
Важную роль в процессе восстановления играет качество чугунной стружки: чем чище и мельче стружка, тем быстрее идет реакция и больше выход аминосоединения. Успешному осуществлению восстановления способствует также хорошее перемешивание реакционной массы.
Восстановление нитросоединений цинковой пылью в среде электролитов на холоду приводит к образованию арилгидроксиламинов ArNHOH. Так, нитробензол при обработке цинковой пылью на холоду в водно-спиртовом растворе хлористого аммония образует фенилгидроксиламин по уравнению:
Дата добавления: 2015-10-21; просмотров: 109 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Пояснения к синтезу | | | Восстановление в кислой среде металлами |