
Читайте также:
|
Пусть в растворе присутствуют две кислоты HA1 и HA2, имеющие константы кислотности, соответственно, Ka1 и Ka2.
[H3O+] = [A-] + [A-] + [OH - ]
| + |
| + |
| + - |
| + - |
| W |
[H3O + ] = Ka1[HA1] _ Ka2[HA2], Kw
[H3O + ] [H3O"] [H3O"]
[H3O + ] = ^Ka1 [HA1] + Ka2[HA2] + K
Если степень протолиза кислот меньше 5%, то их равновесные концентрации можно заменить общими. Кроме того, если Ka[HA] >> KW, то автопротолиз воды можно не учитывать.
[H3O+] ^ V^^^HA^+Ka^HA2
Для n слабых кислот
[H3O +] = yl Ka1CHA1 +... + KanCHAn
Если произведение KaC для двух кислот значительно отличаются, то при расчёте рН влиянием той из них, для которой это произведение значительно меньше, можно пренебречь.
Рассмотрим случай, когда одна из кислот, например, HAi является сильной, а вторая - слабой.
Ka[HA2]
[H3O+] = [A-] + [A-] = Cha1 +
[H3O+]
[H3Ot - cha1 [H3O + ] - Ka[HA2] = 0 С учётом того, что для слабой кислоты [HA2 ] ~ cha2

|
Если в растворе присутствуют два слабых основания, то уравнение электронейтральности (без учёта автопротолиза) имеет следующий вид
[OH - ] = [BH+ ] + [BH+ ]
| K |
| W |
cb1 [H3O+] cb2[h3^]
| K |
| K |
| BHi Л |
| BH2 |
| CB |
| K |
| W |
| + т 2 |
| [H3O + ] |
| + |
| CBi |
| CB2 |
| K |
| BH |
| 2 J |
| + |
| K |
| K |
| BHi |
| BH2 |
[H3O+]
CBi
Kw = [H3O ]
K
BHi
Полученные формулы применимы и для многоосновных кислот и многокислотных оснований. Например, многоосновную кислоту можно рассматривать как смесь кислот (например, H2A и HA-). Так как обычно Kai >> Ka2 и [H2A] во много раз превышает [HA-], то расчёт проводят по тем же формулам, что и для одноосновных кислот.
Пример 4.3. Рассчитать рН: 1) раствора, содержащего 0,10 моль/л CH3COOH (Ka = 1,75 -10'5) и 0,10 моль/л HCOOH(Ka = 1,8-10'4);2) 0,10 М аскорбиновой кислоты (pKa1 = 4,04, pKa2 = 11,34); 3) 0,1 МNa2CO3 (для угольной кислоты pKa1 = 6,35, pKa2 = 10,32)
2) pH = I ■ (4,04 - lg 0,10) = 2,52
3) pH = 2 ■ (14,0 + 2^0,32 + lg 0,l0)= ll,7 Растворы амфолитов
Рассмотрим поведение амфолита HA- (например, HCO3-) в водном растворе.
| +, Л 2- |
| HA- + H2O d H3O+ + A |
HA- + H3O+ d H2A + H2O
| 2- |
[H3O+] = [A[5] ] - [H2A] + [OH- ]
| [H3O+][A2- ] [HA - ] |
| [H3O + ][HA~] [H2A] |
| K |
| и K |
| , следовательно: |
| al |
| a2 |
| W |
| [H3O+] = |
| [H3O+] |
| K |
| al |
| [H3O + ] = |
Ka2-[HA"] [H3O + ][HA"], K
+
[H3O + ]
Kai(Ka2[HA"] + kw)
Kal + [HA"]
Если Ka2[HA ] >> KW, то
| [H3O+] = |

|
KaiKa2[H^"]
Kal + [HA - ]
Если [HA-] * CHA- и [HA-] >> Kal, то
[H3O + ] = ^KaiKa2
Такие же формулы используются и для амфолитов типа BH+A-
Пример 4.4. Рассчитать рН 0,10 М NaHCO3 и 0,10 М HCOONH 4
1) pH = 635+1032 = 843
4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
Рассмотрим двухосновную кислоту H2A.
| Ka = a2 |
[HA-][H3O+] [H2A]
| K |
| ai |
+ ■
[A2- ][H3O4 [HA - ]
Ch2A = [H2A] + [HA-] + [A2- ]
2 [H3O+]2 2 [H3O+] 2 Ch2A = [A2-i + [A2-+ [A2-] =
Ka Ka
| K |
| a2 |
a1 a2
' [H3O+]2 + [H3O+] + 1Л
Ka K„
| [A2- ] |
| K |
| a2 |
V a1 a2
' [H3O + ]2 + Ka1 [H3O + ] + Ka1K '
Ka Ka
| =[A2- ] |
| ai a2 |
a1 a2
Молярные доли частиц будут равны:
a(A2-) = [A2"]
Ka C
| [H2A] [H3O+]2[A2- ] |
| a(H2A) |
| ch2a |
a2
Ka Ka C
| a(HA -) = |
| ch2a |
a1 a2
| Ka Ka a1 a2 |
| CH2A [H3O + ]2 + Ka1 [H3O + ] + Ka1K [HA-] [H3O + ][A2- ] |
| + -л 2-n Ka1 [H3O + ] |
| + ■ |
| a1 a2 |
[H3O + ]2 + Ka1 [H3O4 + Ka1K
"al
| + ■ |
| al a2 |
[H3O+]2
[H3O + ]2 + Ka1 [H3O"] + Ka1K
-al
В общем виде формула для расчёта молярной доли частицы Hn - xAx - имеет следующий вид
| a |
| al a2 |
Kar.Kax[H3O+ ](n-x)
| a(A" | ") = | К a |
| [H3O + ] + Ka | ||
| -PH и | Ka | =10-pKa: |
| a(A | ") = | |
| 1 + 10pKa -pH |

|
| - + - |
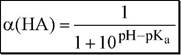
|
Из данных формул следует, что при рН = pKa a(HA) = a(A-) = 0,5. Если рН превышает рКа на 1, то молярная доля А- в 10 раз больше, чем HA, если на 2 - то в 100 раз, на 3 - в 1000 и т.д. При уменьшении рН аналогичным образом увеличивается a(HA) (рис. 4.3).
Если значения Ka для некоторой многоосновной кислоты отличаются друг от друга на 4 и более порядка, то можно считать, что при любом значении рН в равновесной смеси будут присутствовать только два вида частиц, а концентрация остальных пренебрежимо мала. Например, если необходимо рассчитать молярную долю молекул И з Р04 (pKa1 = 2,15; pKa2 = 7,21) при рН 3, то можно принять, что в равновесной смеси присутствуют только частицы И3Р04 и И2Р04 .Рассчёт можно провести по той же формуле, что и для одноосновной кислоты.
| HA | A | ||||||
| 3H = p | >K | ||||||
| \ ^ | ,Ka | ||||||
| a 1,0 0,8 0,6 0,4 0,2 0,0 |
| pH |
Рис. 4.3. Распределительная диаграмма для слабой кислоты (pKa = 5)
Пример 4.5. Рассчитать [NH3] в растворе с общей концентрацией аммиака 0,10 моль/л при рН 7,0.
| = 6,3-10 |
| 1 +10 |
-3
a(NH3) =
9,24-7,0
[NH3 ] = 6,3-10-3 - 0,10 = 6,3 -10-4М
4.7. Кислотно-основные буферные растворы
Буферными растворами, в широком смысле слова, называют системы, поддерживающие определённое значение какого-либо параметра (рН, потенциала системы, концентрации катионов металла), при изменении состава системы.
Кислотно-основным называется буферный раствор, сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении или концентрировании.
Кислотно-основные буферные растворы содержат (в не слишком малых количествах) слабые кислоты и сопряжённые с ними основания.
| + H2O |
кислота основание
| ацетатный | CH3COOH | ! CH3COO" |
| аммиачный | nh4+ | NH3 |
| фосфатный | H2PO4- | HPO42- |
Причина буферного действия таких растворов заключается в следующем.
| H3O4" | + A- d | HA | + H2O | OH- | + HA d | A- |
Сильная кислота при добавлении к буферному раствору «превращается» в слабую кислоту, а сильное основание - в слабое основание. Следовательно, заметного изменения рН раствора при этом не происходит.
Формулу для расчёта рН буферного раствора можно получить следующим образом.
+ Ka[HA] [H3O+] = i

|
[A - ]
Будем считать, что [HA] «Cha и [A ] «C. _
A
KaCHA
[H3O + ]
C
A-
Полученное уравнение называется уравнением Гендерсона - Хассельбаха. Из этого уравнения следует что, что рН буферного раствора зависит от отношения концентраций слабой кислоты и сопря
жённого с ней основания и поэтому незначительно изменяется при разбавлении (или концентрировании).
Разбавление, само собой, не может быть безграничным. При значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов станут такими малыми, что нельзя будет пренебречь автопротоли- зом воды, во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы.
Пример 4.6. Рассчитать рН растворов, полученных 1) при смешивании 100 мл 0,10 М HCOOH и 200 мл 0,10 М НСООИа; 2) 200 мл 0,10 МNH3 и 100 мл 0,10 М HCl.
Вместо концентрации в уравнение Гендерсона-Хассельбаха могут быть подставлены количества кислоты и основания или объёмы их растворов (если концентрация растворённых веществ в последних одинакова)
1) pH = 3,75 - lg100 = 4,05 2) pH = 9,24 - lg001 = 9,24 200 0,01
Способность буферного раствора сопротивляться изменению рН зависит от соотношения концентраций слабой кислоты и сопряжённого с ней основания, а также от их суммарной концентрации в растворе и характеризуется буферной ёмкостью.
Буферной ёмкостью (в или п) называют отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе (без изменения его объёма) к вызванному этим увеличением изменению рН.
в = _ dC к - ты = dC осн
dpH " dpH
Буферную ёмкость раствора можно рассчитать по следующим уравнениям:

|
| + |
Ka(С HA + CA-)
в = 2,3[H3O-]
(Ka + [H3O + ])2
На рис. 4.4. приведён пример зависимости в от рН.
В сильнокислой и сильнощелочной среде буферная ёмкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами, причём даже в большей степени, чем растворы, традиционно рассматриваемые в качестве «буферных». Для растворов сильных кислот в = 2,3[H3O], для растворов сильных оснований в = 2,3[OH].
| рабочая область | ||
| буфера Л | ||
| ■ 1 1 | А ■ ■ | ■__ 1__ 1 1 -х*^\ __ |
| 0,10 |
| 0,05 |
| Рис. 4.4. Зависимость буферной ёмкости 0,2 М ацетатного буферного раствора от рН |
Буферная ёмкость максимальна при рН = рКа и составляет 2,3 0,5 0,5Сбуф = 0,575Сбуф. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рК входящей в его состав слабой кислоты находится как можно ближе к этому рН. Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКа ± 1. Такой интервал называется рабочей областью буфера. Например, рабочая область рН для ацетатного буферного раствора составляет примерно 3,8 - 5,8. Совершенно бессмысленно использовать такой буферный раствор для рН, например, 9.
| в 0,15 |
| 0,00 |
| pH |
Пример 4.7. Рассчитать буферную ёмкость формиатного буферного раствора, упомянутого в примере 4.6. Каким станет рН этого раствора, если к 1 л его добавить 5,0 -10 моль сильной кислоты?
| = 0,033 моль/л = 0,067 моль/л |
| 100+ 200 200 |
| в = 2,3 |
C(HCOOH) = 0,10 C(HCOO -) = 0,10
100+200 0,033 0,067
0,051 моль/л
0,033 + 0,067
| -3 |
| АС в |
| 5,0 10 |
| ApH |
| -2 |
| 5,1 10 |
-0,10, рН раствора станет равным 3,95.
ГЛАВА 5
РАВНОВЕСИЯ К0МПЛЕКС00БРА30ВАНИЯ
5.1. Понятие о комплексном соединении
Чаще всего комплексом называют частицу, образованную в результате донорно-акцепторного взаимодействия атома (иона), называемого центральным атомом (ионом), или комплексообразовате- лем, и заряженных или нейтральных частиц (лигандов). Комплексо- образователь и лиганды должны быть способны к самостоятельному существованию в среде, где происходит реакция комплексообразо- вания.
комплексообразователь лиганды
i I
K3[Fe(CN)6]
t—V—л_..___ I
Т I
внешняя сфера ',
, К внутренняя сфера
(противоион), ч
(комплексная частица)
Реакцию комплексообразования можно рассматривать как реакцию взаимодействия кислоты и основания Льюиса.

|
Mn+ + L- г ML(n-1)+
\ t
комплексообразователь лиганд
(кислота Льюиса) (основание Льюиса)
Количественной характеристикой способности комплексообра- зователя и лиганда участвовать в донорно-акцепторном взаимодействии при образовании комплексной частицы являются, соответственно, координационное число и дентатность.
Дентатностью лиганда называется число донорных центров (неподелённых электронных пар либо п-связей) лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы.
Лиганды бывают:
монодентатными (СГ, H2O, NH3),
| 5.2. Классификация комплексных соединений |
бидентатными (C2O4 ", этилендиамин, 1,10-фенантролин) полидентатными.
! OOC^CH^.v,,-.-.>CH2^COO!
WcHrcHi-Nxi г-------™;
! OO^rCH^ " CH^COO j i_____________; i '
гексадентатный лиганд
Координационным числом называется число донорных центров лигандов, с которыми взаимодействует данный центральный атом (ион).
| комплексы с монодентатными лигандами | комплексы с полидентатными лигандами | ||||
| КЧ = число лигандов | КЧ = число лигандов • дентатность | ||||
| [Ag(NH3)2]+ [Ag^Os^]3- I / I / КЧ = 2 КЧ = 2 - 2=4 |
 у Ag+ максимальное КЧ равно 4, характеристическое для аммиачных комплексов - 2
у Ag+ максимальное КЧ равно 4, характеристическое для аммиачных комплексов - 2
|
HgCl2

|

|
Соединения, образующиеся при взаимодействии насыщенных по координационному числу внутрисферных комплексов и любых частиц, находящихся во внешней сфере, называются внешнесферными комплексами.
Например (внутрисферные комплексные частицы выделены полужирным шрифтом):
[(C4H9)N4]2[Co(SCN)4]; [Ba(OH)d • RSO3; ^d^he^^^^O^, (phen - фенантролин); / + \
[SbCl6]-
fll
При образовании внешнесферного комплекса центральный ион не образует новой химической связи, взаимодействие происходит между лигандами внутренней сферы и частицами внешней сферы. Внешнесферные комплексы отличаются от обычных ионных пар (ионных ассоциатов) тем, что последние образуются в результате только электростатического взаимодействия полностью или частично сольватированных ионов, в то время как при образовании внешне- сферных комплексов происходит образование ковалентной связи, водородной связи, имеет место ион-дипольное, гидрофобное взаимодействие и др.
Циклические комплексные соединения катионов металлов с по- лидентатными лигандами (обычно органическими), в которых центральный ион металла входит в состав одного или нескольких циклов, называются хелатами.

|
| H |
| H |
| H H \ / |
| 2+ |
| HH ON ^ /с\ ^ NO H H |
| O |
| / N |
| N V 7 /с\ NN / \ / \ H H H H |
| O |
| ! |
внутрикомплексные соединения
Ковалентные связи, образованные по донорно-акцепторному механизму, часто обозначают стрелкой показывающей переход электронов от донорно- го центра лиганда к иону металла. Поскольку такие связи ничем не отличаются от обычных ковалентных связей, то их можно обозначать и простой чёрточкой.
5.3. Равновесия в растворах комплексных соединений
Внутренняя сфера связана с внешней ионной связью, поэтому в растворе соединение, содержащее комплексный ион, ведёт себя как сильный электролит. Например:
[Ag(NH3)2]NO3 ^ [Ag(NH3)2]+ + NO3-
Между центральным ионом и лигандами образуются ковалентные связи по донорно-акцепторному механизму. Процесс комплексо- образования происходит обратимо.
|
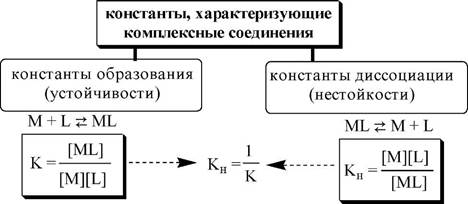
Обычно в состав комплексного соединения входит несколько лигандов, и процессы комплексообразования протекают ступенчато. Константы равновесия, характеризующие отдельную ступень, называются ступенчатыми (K). Произведение ступенчатых констант представляет собой общую константу (Pn, n - число ступеней), например (табл. 5.1).
Табл. 5.1
Константы образования аммиачных комплексов серебра
| Комплекс |
| Общая константа образования |
Ступенчатая константа _ образования
[Ag(NH3) + ] 3
i__6+--- = 2д. 103
[Ag+ ][NH3]
| [Ag(NH3)]+ |
| Pi = K] |
| K1 = |
lgKi = 3,32
| [Ag(NH3)2]+ |
| [Ag(NH3)2+] [Ag(NH3) + ][NH3] lgK2 = 3,91 |
| K2 = |
| = 8,1-10 |
[Ag(NH3)2+ ] =
P2 = K1K2 =
[Ag+ ][NH3]2 =1,7 -107 lgp2 = lg K1 + lgK2 = 7,23
Чем больше величина константы образования (для однотипных комплексов!), тем выше устойчивость комплекса.
n2+
[Co(NH3)4]2+ [Cd(NH3)4]2+ [Ni(NH3)4]ZT [Zn(NH3)4^ [Cu(NH3)4] lgP4 (5,07) 1 1 (9,08) (12,03
увеличение устойчивости
Наоборот, более устойчивому комплексу соответствует меньшая константа диссоциации
| n2+ |
| 2+ |

|

|
Константы, используемые для описания равновесий в растворах комплексных соединений, как и любые константы равновесия, могут быть термодинамическими и концентрационными (реальными и условными). Например, для комплекса MLn

|

|
[MLn]
в n =
[M][L]n

|
Данные константы связаны между собой следующим образом
Pn =Рn M L
Константы равновесия характеризуют термодинамическую стабильность комплекса - меру возможности образования или диссоциации данного комплекса в равновесных условиях. Существует также понятие «кинетическая устойчивость», характеризующее скорость образования (диссоциации) комплексной частицы. В зависимости от скорости замещения лигандов внутренней сферы на другие лиганды комплексы разделяют на
| инертные комплексы |
| 2+ |
| [Cu(NH3)4] |
кинетическая устойчивость комплексов
лабильные комплексы
[Сг(КИз)б]3+
химическая реакция с участием период полупревращения комплекса протекает за время комплекса превышает
меньшее, чем, примерно, 1 минута 2 минуты
(время смешения реагентов)
5.4. Влияние различных факторов на комплексообразование в растворах
На процессы комплексообразования оказывают влияние природа комплексообразователя и лигандов, температура, ионная сила раствора, концентрация реагентов, а также побочные реакции, протекающие в растворе (протонирование лиганда при изменении рН, образование малорастворимых соединений и др.)
Дата добавления: 2015-09-07; просмотров: 276 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Растворы слабых кислот или слабых оснований | | | Природа комплексообразователя и лигандов |