
Читайте также:
|
Задача 1. Находящийся при нормальных физических условиях воздух объемом 10 м3 сжимается обратимо до конечной температуры 400ºC. Сжатие производится изохорно, адиабатно, изобарно, политропно с показателем n =2,2. Считать воздух идеальным двухатомным газом с m=28,97 кг/кмоль; использовать теоретические значения теплоемкостей. Определить энтропию воздуха в конце каждого процесса, принимая ее равной нулю в исходном состоянии.
Решение
а). Находим массу воздуха:
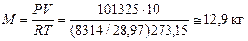 .
.
б). Находим сv, сp, k= сp/ сv, с п = сv (n–k)/(n –1):
 ;
;  ;
;  ;
;
cp =1004,5 Дж/(кг К)@1,005 кДж/(кг К).
k= сp/ сv =7/5=1,4. c п=717,5(2,2–1,4)/(2,2–1)=521,8 Дж/(кг К).
в). Определяем изменение энтропии в каждом процессе.
1. Изохорный процесс. Из формулы (6.2) следует (т.к. s 1=0)
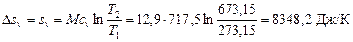 ;
;
2. Изобарный процесс. Из формулы (6.3) следует
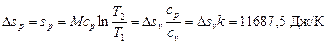 .
.
3. Адиабатный процесс. Поскольку процесс обратимый, то это одновременно и изоэнтропийный процесс:

4. Политропный процесс (dS = Mc п dT/T)
 .
.
Задача 2. В сосуде объемом V =300 л заключен воздух при давлении P 1=5 МПа и температуре t 1=20ºC. Параметры среды: P 0=0,1 МПа, t 0=20ºC. Определить максимальную полезную работу, которую может произвести сжатый воздух, считая его идеальным двухатомным газом.
Решение
а). Переводим величины в единицы СИ: V =300·10–3 м3 = 0,3 м3; P 1=5·106 Па; T 1=293,15К.
б). В конечном состоянии P 2= P 0, T 2= T 0= T 1. Так как газ идеален, а T 2= T 1, то du =0 и D u =0 (закон Джоуля).
В соответствии с (6.5), т.к. D u =0, для 1 кг воздуха
ex = T 0(s 2– s 1)– P 0(v2 – v 1) (Дж/кг).
Из (6.3) получаем
D s = s 2– s 1 = R ln(P 1 /P 2) = (8314/28,97)·ln(5/0,1)@1,123 кДж/(кг·К).
Масса воздуха
М = P 1 V 1/ RT 1 @ (5·106·0,3)/(287·293)=17,84 кг.
v 1= V / M =0,0168 м3/кг; v 2= v 1 P 1/ P 2 = 0,841 м3/кг; V 2= v 2 M =15 м3;
ex @293·1123–105(0,841–0,0168)=245,5 кДж/кг.
Для всей массы воздуха получаем
Ex= M ex @ 4377 кДж.
Задача 3. В проточном теплообменнике нагревается воздух. Параметры воздуха на входе в теплообменник: P 1=0,7 МПа, t 1=140ºC, на выходе P 2=0,63 МПа, t 2=800ºC. Параметры среды: P 0=0,1 МПа, t 0=15ºC. Определить изменение эксергии 1 кг потока воздуха в теплообменнике. Воздух считать идеальным газом.
Решение
а). Переводим величины в единицы СИ: P 1=7·105 Па; T 1=413,15К; P 2=6,3·105 Па; T 2=1073,15 К; P 0=105 Па; T 0=288,15К.
б). Из уравнения (6.6) для эксергии потока на входе и выходе получаем (для 1 кг воздуха)
ex 1= h 1– h 0– T 0(s 1– s 0),
ex 2= h 2– h 0– T 0(s 2– s 0).
Изменение эксергии
d = ex 2– ex 1 = h 2 – h 1 – T 0(s 2– s 1),
D h = h 2 – h 1= c p (T 2 – T 1) (закон Джоуля),
D s = s 2 – s 1 = сp ln(T 2 /T 1) – R ln(P 2 /P 1) (уравнение (6.3)),
D h= 1004,5(800–140)@663 кДж/кг,
D s= 1004,5·ln (1073,15/413,15)–(8314/28,97)·ln(63/70)@989 Дж/кг.
T 0D s= 288,15·989@285 кДж/кг.
Окончательно
d= 663–285 = 378 кДж/кг.
Задачи
6.1. 1 кг воздуха сжимается обратимо от P 1=1 бар и t 1=15ºC до P 2=5 бар и t 2=100ºC. Определить изменение энтропии. Теплоемкость считать постоянной.
6.2. Определить изменение энтропии в процессе испарения 3 кг азота в политропном процессе при изменении температуры от t 1=100ºC до t 2=300ºC. Показатель политропы n =1,2. Теплоемкости принять по молекулярно-кинетической теории. Изобразить процесс в P-v- и T-s- диаграммах.
6.3. Определить изменение энтропии в процессе испарения 1 кг воды при температуре, равной 100ºC, если известно, что теплота парообразования r =2257 кДж/кг.
6.4. 50 кг льда с начальной температурой –5ºC помещены в воздух с температурой +15ºC. Считая, что образующаяся при таянии вода нагреется до температуры воздуха, определить увеличение энтропии, происходящее в результате этого процесса. Теплота таяния льда l=333 кДж/кг, теплоемкость льда сp = =2,03 кДж/(кг·К). Теплоемкость воды принять равной 4,187 кДж/(кг·К).
6.5. Определить приращение энтропии 3 кг воздуха а) при нагревании его по изобаре от 0 до 400ºC; б) при нагревании его по изохоре от 0 до 880ºC; в) при изотермическом расширении с увеличением объема в 16 раз. Теплоемкость считать постоянной.
6.6. Средняя теплоемкость алюминия сp в интервале температур от 0 до 300ºC равна 0,955 кДж/(кг·К). Определить энтропию 100 кг алюминия при 300ºC, считая, что его энтропия при 0ºC равна нулю.
6.7. 1 кг воздуха сжимается по политропе от 1 бар и 20ºC до 8 бар при n =1,2. Определить конечную температуру, изменение энтропии, количество отведенного тепла и затраченную работу.
6.8. В процессе политропного расширения воздуха температура его уменьшилась от t 1=25ºC до t 2= –37ºC. Начальное давление воздуха P 1=4 бар, количество его m =2 кг. Определить изменение энтропии в этом процессе и конечное давление воздуха, если известно, что количество подведенного к воздуху тепла составляет 89,2 кДж.
6.9. 30 л воды с температурой 90ºC смешиваются с 20 л воды с температурой 15ºC. Определить вызванное этим процессом изменение энтропии. Теплоемкость воды принять равной 4,187 кДж/(кг·К). Считать, что тепловые потери отсутствуют.
6.10. Стальной шар массой 10 кг при 500ºC погружается в сосуд с 18 кг воды, температура которой равна 15ºC. Определить изменение энтропии системы в этом процессе. Считать, что тепловые потери отсутствуют. Теплоемкость принять равной 0,5129 кДж/(кг·К), теплоемкость воды 4,187 кДж/(кг·К).
6.11. Определить энтропию 1 кг газовой смеси, состоящей из азота и аргона, при P 1=0,3 МПа и t1 =300ºC. Массовые доли азота и аргона: g N2=0,37, g Ar=0,63. Газы считать идеальными; принять, что при P 0=0,1 МПа и t 0=0ºC энтропии азота и аргона равны нулю.
6.12. Определить, насколько увеличится энтропия при смешении 3 кг азота и 2 кг углекислого газа. Газы считать идеальными. Температура и давление газов до смешения одинаковы.
6.13. Определить эксергию воздуха в баллоне. Давление воздуха в баллоне 15 МПА, температура равна температуре среды. Параметры окружающей среды (воздуха): P 0=0,1 МПа, t 0=15ºC. Объем баллона 40 дм3. Воздух считать идеальным газом.
6.14. Определить эксергию воздуха в баллоне. Известны давление и температура воздуха: P =13 МПа, t =200ºC. Параметры окружающей среды: P 0=0,1 МПа, t 0=20ºC. Объем баллона 25 дм3. Воздух считать идеальным газом.
6.15. Определить эксергию азота, находящегося в пьезометре экспериментальной установки при P =25 МПа, t =200ºC. Параметры среды: P 0=0,1 МПа, t 0=20ºC. Объем пьезометра 500 см3. Азот считать идеальным газом.
6.16. Определить эксергию 100 кДж теплоты при температуре 700ºC. Температура среды 0ºC. Определить потерю эксергии этой теплоты, если последняя будет передана тепловому источнику с температурой 500ºC.
6.17. Определить эксергию количества теплоты, которое получается в результате сгорания на воздухе 1 кг топлива с теплотой сгорания Q иp=25,0 МДж/кг; температура горения 1500ºC; температура окружающей среды t 0=20ºC; теплоемкость продуктов сгорания принять постоянной.
6.18. Для некоторых горячих источников температура газа, выходящего из земли, доходит до 180ºC (давление атмосферное). Определить эксергию 1 кг газа. Температура среды t 0=20ºC. Считать, что газ по своим термодинамическим свойствам является идеальным и идентичен углекислому газу. Определить максимальный термический к.п.д., который имел бы тепловой двигатель, превращающий теплоту этого источника в работу.
6.19. Определить эксергию 1 кг выходящего из подземных источников водяного пара. Температура пара равна 100ºC, давление атмосферное. Температура окружающей среды 10ºC. Принять, что теплота парообразования r =2257 кДж/кг, а теплоемкость воды сp =4,187 кДж/(кг·К).
6.20. В сосуде объемом 300 л заключен воздух при давлении P 1=50 бар и температуре t =20ºC. Параметры среды: P 0=1 бар, t 0=20ºC. Определить максимальную полезную работу, которую может произвести сжатый воздух, находящийся в сосуде.
6.21. В сосуде объемом 200 л находится углекислота при температуре t 1=20ºC и давлении P 1=100 бар. Температура среды t 0=20ºC, давление среды P 0=1 бар. Определить максимальную полезную работу, которую может произвести находящаяся в сосуде углекислота.
6.22. Торпеда приводится в действие и управляется автоматически, двигаясь на заданной глубине. Для двигателя торпеды используется имеющийся в ней запас сжатого воздуха. Определить максимальную полезную работу, которую может произвести воздушный двигатель торпеды, если объем сжатого воздуха в ней V 1=170 л, давление P 1=180 бар, а температура воздуха и морской воды t 0=10ºC. Торпеда отрегулирована на движение под уровнем моря на глубине 4 м. Определить также силу, с которой торпеда устремляется вперед, если радиус ее действия должен быть равен 4 км, а потерями можно пренебречь.
6.23. Определить максимальную полезную работу, которая может быть произведена 1 кг кислорода, если его начальное состояние характеризуется параметрами t 1=400ºC и P 1=1 бар, а состояние среды – параметрами t 0=20ºC, P 0=1 бар. Представить процесс в диаграммах P-v, T-s.
6.24. В сосуде объемом 400 л заключен воздух при давлении P 1=1 бар и температуре t 1= –400C. Параметры среды: t 0=20ºC, P 0=1 бар. Определить максимальную полезную работу, которую может произвести воздух, заключенный в сосуд. Представить процесс в диаграммах P-v, T-s.
Дата добавления: 2015-10-29; просмотров: 1436 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Второй закон термодинамики. | | | Равновесная парожидкостная смесь |