
Читайте также:
|
1s <2s <2p <3s <3p <4s <3d <3p <5s <4d <5p <6s <4f <5d <6p <7s <5f <6d <7p <8s
Следствием решения уравнения Шредингера для атома водорода являются четыре квантовых числа, характеризующих поведение электрона в атоме.
Состояние электрона в атоме полностью характеризуется четырьмя квантовыми числами: n, l, ml и ms.
Главное квантовое число n
Определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия.
Главное квантовое число n определяет расположение электрона на том или ином энергетическом уровне (квантовом слое).
Главное квантовое число имеет значения ряда целых чисел от 1 до ∞. При значении главного квантового числа n=1, электрон находится на первом энергетическом уровне, расположенном на минимально возможном расстоянии от ядра. Полная энергия такого электрона наименьшая.
Электрон, находящийся на наиболее удаленном от ядра энергетическом уровне, обладает максимальной энергией. Поэтому при переходе электрона с более удаленного энергетического уровня на более близкий выделяются порции (кванты) энергии. Энергетические уровни обозначают прописными буквами согласно схеме:
Значение n 1 2 3 4 5
Обозначение K L M N Q
Орбитальное квантовое число l.
Согласно квантово-механическим расчетам, электронные облака отличаются не только размерами, но и формой.
Форму электронного облака характеризует орбитальное квантовое число. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т. е. ее расщепление на энергетические подуровни.
Каждой форме электронного облака соответствует определенное значение механического момента движения электрона μ, определяемого орбитальным квантовым числом:
 .
.
Орбитальное квантовое число может иметь значения от 0 до n-1, всего n значений. Энергетические подуровни обозначают буквами:
Значение l 0 1 2 3 4 5
Обозначение s р d f g h
При значении главного квантового числа, равного единице (n=1), орбитальное квантовое число имеет только одно значение, равное нулю (l=0). Таким значением l характеризуются электронные облака, имеющие шаровую симметрию. Электроны, орбитальное квантовое число которых равно нулю, называются s-электронами.
Магнитное квантовое число ml.
Из решения уравнения Шредингера следует, что электронные облака ориентированы в пространстве.
Пространственная ориентация электронных облаков характеризуется магнитным квантовым числом.
Магнитное квантовое число принимает любое целое числовое значение от +l до -l, включая 0.
Таким образом, число возможных значений магнитного квантового числа равно 2l+1.
При значении орбитального квантового числа (l=0), магнитное квантовое число имеет только одно значение, равное нулю (ml=0).
При значении орбитального квантового числа (l=1), магнитное квантовое число имеет три значения: ml=1, ml=0 и ml =-1.
Три значения магнитного числа характеризуют три состояния р-электронов, что соответствует ориентации в пространстве в трех взаимно перпендикулярных плоскостях по осям координат х, у и z.
При значении орбитального квантового числа (l=2), магнитное квантовое число имеет пять значений: ml=2, ml=1, ml=0, ml=-2, ml=-1.
Пять значений магнитного квантового числа соответствуют пяти пространственным положениям d-электронных облаков.
Орбитальному квантовому числу (l=3), соответствует семь значений магнитного числа и семь пространственных положений f-облаков.
Атомные орбитали (АО)
На основе представлений о квантовых числах можно уточнить определение электронной орбитали в атоме.
Совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел n, l и ml, называют атомной орбиталью (АО). Условно АО обозначают в виде клетки (энергетической ячейки):  .
.
Число АО равно:
Единице — на s-подуровнях 
трем — на р-подуровнях 


пяти — на d-подуровнях 




семи — на f-подуровнях 






Три р-орбитали (рх, рy, pz) перпендикулярны друг другу и направлены вдоль трех осей координат: х, у и z.
Три d-орбитали (dxz, dyz, dxy) имеют диагональное расположение между осями х, y и z, две остальные (dx2y2, dz2) направлены вдоль осей координат.

Электронные р-облака (l= 1): 2pz-орбиталь;2px-орбиталь;2py-орбиталь
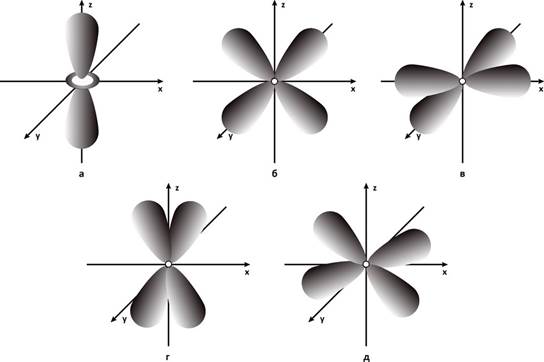
Электронные d-облака (l= 2): а - 3dz2-орбиталь; б - 3dxz-орбиталь; в - 3dx2y2-орбиталь; г - 3dyz-орбиталь; д - 3dху-орбиталь
Спиновое квантовое число ms.
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментом импульса, характеризующим его веретенообразное вращение вокруг собственной оси.
Это свойство электрона получило название спина.
Величину и ориентацию спина характеризует спиновое квантовое число ms, которое может принимать значения ms=+½ и ms=-½.
Положительное и отрицательное значения спина связаны с его направлением. Поскольку спин — величина векторная, его условно обозначают стрелкой, направленной вверх или вниз: ↓ или ↑.
Электроны, имеющие одинаковое направление спина, т. е. либо ms=+½, либо ms=-½, называются параллельными, при противоположных направлениях спинов — антипараллельными.
На атомной орбитали (в квантовой ячейке) может находиться не более двух электронов:
к подуровню s относится одна s -орбиталь и не более двух электронов:

к подуровню р относятся три р -орбитали и не более шести электронов:

к подуровню d относятся пять d -орбиталей и не более десяти электронов:

к подуровню f относятся семь f -орбиталей и не более четырнадцати электронов:


|
| Последовательность заполнения электронами энергетических уровней и подуровней согласно правилу Клечковского |
Пример заполнения электронной структуры атома Церия (Ce58)
Ce58 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f2 5s2 5p6 5d0 6s2
max=2 max=8 max=18 max=32 max=18 max=2
Структура периодической системы элементов Д.И.Менделеева.
Периодическая система состоит из периодов и групп. Порядковый номер элемента в периодической системе равен заряду ядра, а также количеству электронов в оболочке нейтрального атома.
Период – последовательный ряд элементов, атомы которых различаются числом электронов в наружном слое.
Каждый период начинается типичным металлом и завершается благородным газом. Номер периода совпадает со значением главного квантового числа внешнего электронного уровня.
Принадлежность элементов к группам и деление их на подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством электронов в этих слоях элементы периодической системы разделены на 8 групп.Номер группы совпадает с числом валентных электронов элемента.
Валентными являются в первую очередь n s- и n p-электроны (n – номер внешнего электронного слоя), а затем (n –1)d-электроны
Валентность - способность свободных его атомов к образованию определённого числа ковалентных связей
Спин-Валентность - число связей образуемых атомом.
Дата добавления: 2015-10-24; просмотров: 967 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Правило В. Клечковского | | | Теория сильных электролитов (1923) |