
Читайте также:
|
Рассмотрим синтез стероидных лекарственных препаратов, в частности кортикостероидов общей формулы:

где R1 -  - или -
- или - 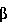 -OH-группа или H, R2 -H или OH-группа или F, или вместо R1, R2 - двойная связь, R3- H, или CH3-группа, или F, R4 - H или OH-группа, R5 -
-OH-группа или H, R2 -H или OH-группа или F, или вместо R1, R2 - двойная связь, R3- H, или CH3-группа, или F, R4 - H или OH-группа, R5 -  - или
- или 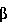 -CH3- группа или атом H, R6=H или Ас, из стеринов растительного и животного происхождения. 3,17-дикетоандростаны общей формулы:
-CH3- группа или атом H, R6=H или Ас, из стеринов растительного и животного происхождения. 3,17-дикетоандростаны общей формулы:

подвергают цианированию, защите 17-  - ОН группы с помощью алкилвинилового эфира, защите 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя и алкилированию 17-СN-группы с последующим гидролизом. Полученное соединение подвергают галоидированию С 21 положения путем прямого иодирования с последующим замещением иода на окси- или ацетокси-группу. Способ позволяет повысить выход целевого продукта.
- ОН группы с помощью алкилвинилового эфира, защите 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя и алкилированию 17-СN-группы с последующим гидролизом. Полученное соединение подвергают галоидированию С 21 положения путем прямого иодирования с последующим замещением иода на окси- или ацетокси-группу. Способ позволяет повысить выход целевого продукта.
17-Кетостероиды - ключевые полупродукты в синтезе практически всей номенклатуры стероидных лекарственных препаратов из стеринов растительного и животного происхождения (ситостерина и холестерина), которые в настоящее время являются наиболее доступным и дешевым источником стероидного сырья.
Известно несколько способов построения диоксиацетоновой боковой цепи кортикостероидов, заключающихся в стереоселективном построении прегнановой цепи с последующим введением кислородной функции по С-21-углеродному атому стероидной молекулы. Гидроксилирование 21-го положения молекулы 17  гидроксипрогестерона может быть осуществлено путем его предварительного иодирования с последующим замещением атома иода при С-21 на гидрокси- или ацетоксигруппу.
гидроксипрогестерона может быть осуществлено путем его предварительного иодирования с последующим замещением атома иода при С-21 на гидрокси- или ацетоксигруппу.
Известен способ получения кортикостероидов, заключающийся в том, что прегнан подвергают галоидированию С-21 положения путем непрямого введения атома иода с последующим замещением галоида на гидрокси-группу.
В предложенном способе высокий выход целевого продукта достигается путем проведения построения прегнановой цепи с устойчивой защитой  4 -3-кетогруппы.
4 -3-кетогруппы.
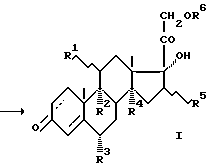
Технический результат достигается тем, что в способе получения кортикостероидов общей формулы I:

где R1-  -или
-или 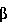 -OH-группа или атом H, R2 -H или ОН, или F, или вместо R1,R2 –двойная связь, R3 -H, или F, или CH3-группа, R4 -H или OH-группа, R5 -
-OH-группа или атом H, R2 -H или ОН, или F, или вместо R1,R2 –двойная связь, R3 -H, или F, или CH3-группа, R4 -H или OH-группа, R5 -  - или
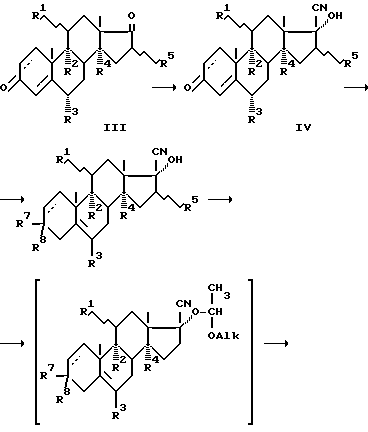
- или 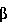 - CH3-группа или атом H, R6 - H или Ac, заключающемся в том, то прегнаны общей формулы II:
- CH3-группа или атом H, R6 - H или Ac, заключающемся в том, то прегнаны общей формулы II:

где R7 и R8 вместе кетогруппа или незамещенный,
2-монозамещенный или 2,2-дизамещенный пропиленкефаль,
подвергают галоидированию С-21 положения с последующим замещением галоида на гидрокси- или ацетокси-группу, для получения прегнанов в качестве исходного соединения используют 3,17 - дикетоандростаны общей формулы III:

которые подвергают цианированию, защите 17  -OH группы, защите 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя и алкилированию 17-CN-группы с последующим гидролизом.
-OH группы, защите 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя и алкилированию 17-CN-группы с последующим гидролизом.
Кроме того, галоидирование можно осуществлять путем прямого иодирования.
Кроме того, для защиты 17  -ОН-группы можно использовать алкилвиниловый эфир.
-ОН-группы можно использовать алкилвиниловый эфир.
Цианидринный метод введения оксипрегнановой боковой цепи заключается в гидроцианировании 17-кетостероидов с образованием преимущественно 17 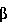 -карбонитрила. Защита 3-кетогруппы и 17
-карбонитрила. Защита 3-кетогруппы и 17  ОН - гидроксигруппы, последующее метилирование нитрильной группы и гидролиз приводят к образованию 17
ОН - гидроксигруппы, последующее метилирование нитрильной группы и гидролиз приводят к образованию 17  -гидроксипрегнановой боковой цепи.
-гидроксипрегнановой боковой цепи.
Для защиты 17  - гидроксигруппы проводят ее этерификацию триметилхлорсиланом или алкилвиниловыми эфирами и др.
- гидроксигруппы проводят ее этерификацию триметилхлорсиланом или алкилвиниловыми эфирами и др.
Защита  4 -3-кетогруппы может быть осуществлена образованием енол-эфира, кеталя или енамина. При этом наиболее предпочтительным кеталем был признан этиленкеталь. Однако при этом защита
4 -3-кетогруппы может быть осуществлена образованием енол-эфира, кеталя или енамина. При этом наиболее предпочтительным кеталем был признан этиленкеталь. Однако при этом защита  4 -3-кетогруппы обеспечивается реакцией с этиленгликолем) и образованием пятичленного 1,3-диоксоланового цикла. Пятичленный цикл является более напряженным (трансаннулярное, питцеровское напряжения), чем шестичленный 1,3-диоксановый цикл, образующийся при защите указанной выше
4 -3-кетогруппы обеспечивается реакцией с этиленгликолем) и образованием пятичленного 1,3-диоксоланового цикла. Пятичленный цикл является более напряженным (трансаннулярное, питцеровское напряжения), чем шестичленный 1,3-диоксановый цикл, образующийся при защите указанной выше  4 -3-кетогруппы взаимодействием с 1,3-пропандиолом, где эти напряжения отсутствуют.
4 -3-кетогруппы взаимодействием с 1,3-пропандиолом, где эти напряжения отсутствуют.
Кроме того, известно, что алкилирование CN-группы 3,3-этиленкеталя 17-циангидрина андростендиона реактивом Гриньяра, где гидроксил при С-17 защищен, например, триметилсилиловым эфиром, требует достаточно жестких условий (длительное кипячение в ТГФ или применение высококипящих растворителей, например, анизола) и сопровождается побочной реакцией по 1,3-диоксолановому кольцу с образованием продукта его расщепления по C-O-связи 3  метил- 3
метил- 3  (оксиэтокси) - прегн -5-ен- 17
(оксиэтокси) - прегн -5-ен- 17  -ол-20-она с высоким выходом (в анизоле-количественным.
-ол-20-она с высоким выходом (в анизоле-количественным.
В предложенном способе применена защита  4 -3- кетогруппы стероидной молекулы с образованием 1,3- диоксанового цикла с использованием незамещенных, 2-моно-и 2,2-дизамещенных 1,3- пропандиолов, например, 2,2-диметил-1,3-пропандиола (неопентилгликоль).
4 -3- кетогруппы стероидной молекулы с образованием 1,3- диоксанового цикла с использованием незамещенных, 2-моно-и 2,2-дизамещенных 1,3- пропандиолов, например, 2,2-диметил-1,3-пропандиола (неопентилгликоль).
Образование 1,3-диоксаноаого кольца более предпочтительно в качестве защитной группировки, так как протекает легче с образованием термодинамически более выгодной структуры (Выход пятичленного циклического кеталя составляет 84,2%, по предложенному способу 95-98%).
Кроме того, в условиях проведения реакции алкилирования такая защита является более устойчивой и позволяет проводить реакцию как в мягких условиях с применением метиллития в качестве метилирующего агента, так и в более жестких условиях реакции Гриньяра. При этом сравнительное изучение защит при проведении метилирования в одинаковых условиях показало значительное преимущество 1,3-диоксановой защиты по предложенному способу в выходе целевого продукта: выход 17-гидроксипрогестерона с применением 1,3-диоксолановой защиты - 88,5%, a с применением 1,3-диоксановой защиты по предложенному способу - 99,4%.
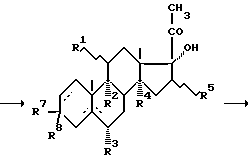
В предложенном способе предпочтительно использование прямого иодирования С-21 положения в присутствии оксида кальция и каталитических количеств солей щелочных и щелочноземельных металлов. Последующей реакцией нуклеофильного замещения атома иода на ацетокси-группу в апротонном растворителе получают 21-ацетокси- 17  -гидрокси-производное с высоким выходом.
-гидрокси-производное с высоким выходом.
Схема получения кортикостероидов
R7 и R8 вместе незамещенный, 2-монозамещенный или 2,2- дизамещенный пропиленкеталь:
где IIа: R7 и R8 вместе кето-группа;  4 IIб: R7 и R8 вместе пропиленкеталь,
4 IIб: R7 и R8 вместе пропиленкеталь,  5
5

VIIа: R7 и R8 вместе кето-группа;  4 VIIб: R7 и R8 вместе пропиленкеталь;
4 VIIб: R7 и R8 вместе пропиленкеталь;  5
5
Примеры осуществления предложенного способа (R1 = R2 = R3 = R4 = R5 = H).
Пример 1. Получение 17  - гидрокси - 17
- гидрокси - 17 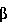 цианандрост - 4 ен-3-она [(IV), R1 = R2 = R3 = R4 = R5 = H].
цианандрост - 4 ен-3-она [(IV), R1 = R2 = R3 = R4 = R5 = H].
К раствору 1,63 г NaOH в 280 мл метанола добавляют 100 г андростендиона (III). Суспензию нагревают до 40oC и добавляют последовательно 13,8 мл воды и 47,8 мл ацетонциангидрина. Реакционную массу выдерживают при температуре 35... 36oC в течение часа и добавляют медленно по каплям 59 мл воды, затем выдерживают при комнатной температуре. По окончании реакции добавляют медленно
217 мл воды и выдерживают 2 часа при комнатной температуре. Осадок отфильтровывают, промывают на фильтре смесью воды и метанола (2:1 соответственно) и водой до pH 7.
Получают 104,45 г соединения (IV) с выходом 95,5% с температурой плавления 174 - 176oC.
Пример 2. Получение 17  - гидрокси - 3,3 (2,2 - диметил-пропилендиокси) - андрост - 5 ен - 17
- гидрокси - 3,3 (2,2 - диметил-пропилендиокси) - андрост - 5 ен - 17 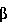 - карбонитрила (V) (R1 = R2 = R3 = R4 = R5 =H).
- карбонитрила (V) (R1 = R2 = R3 = R4 = R5 =H).
Суспензию 104,45 г соединения (IV) в 522 мл хлористого метилена охлаждают до температуры -0...-5oC и в токе азота добавляют последовательно 105 мл триэтилового эфира ортомуравьиной кислоты, 156,7 г неопентилгликоля и 15,67 г п-толуолсульфокислоты. Реакционную массу перемешивают в течение 8 часов. По окончании реакции медленно добавляют раствор 68,3 г гидрокарбоната натрия в 1,3 л воды. Суспензию охлаждают до температуры 0...+5oC и выдерживают в течение часа. Осадок отфильтровывают, промывают водой до pH 7.
Получают 130,52 г хроматографически чистого соединения (V) с выходом 98% с температурой плавления 252oC (с разложением).
Пример 3. Получение 17  - гидроксипрогестерона (IIа).
- гидроксипрогестерона (IIа).
К суспензии 130,52 г соединения (V) и 2,61 г п- толуолсульфокислоты в 1,175 л тетрагидрофурана в токе сухого азота при комнатной температуре добавляют 130,52 мл винилэтилового эфира. Суспензию перемешивают до растворения осадка и добавляют 3,26 мл триэтиламина (pH 8). Реакционную массу охлаждают до температуры -30oC и медленно по каплям добавляют 784 мл 1,4М раствора метиллития в эфире. Реакционную массу медленно подогревают до комнатной температуры и перемешивают в течение 2 часов. По окончании реакции реакционную смесь охлаждают до температуры 0...+5oC и добавляют медленно по каплям смесь 260 мл соляной кислоты, 260 мл воды и 650 мл метанола (рН 2). Реакционную массу перемешивают до окончания реакции гидролиза кетальной группы при C-3 и затем разбавляют 1,83 л воды. По окончании выдержки (1 час при комнатной температуре) осадок отфильтровывают. После перекристаллизации из ацетона с углем получают 107,3 г соединения (IIа) с выходом 99,4%, с температурой плавления 234oC.
Пример 4. Получение 17  - гидрокси -3,3 (2,2- диметилпропилендиокси - прегн -5 ен- 20-она (IIб)
- гидрокси -3,3 (2,2- диметилпропилендиокси - прегн -5 ен- 20-она (IIб)
Реакцию метилирования соединения (V) (20 г) проводят в условиях примера 3. По окончании реакции реакционную массу охлаждают до температуры 0...+5oC, добавляют медленно по каплям смесь 0,6 мл соляной кислоты и 0,6 мл воды, затем разбавляют 180 мл воды и перемешивают в течение часа. Осадок отфильтровывают.
После перекристаллизации иp хлористого метилена с углем получают 20,64 г хроматографически чистого соединения (IIб) с выходом 99%.
Пример 5. Получение 17  - гидроксипрогестерона (IIа).
- гидроксипрогестерона (IIа).
К раствору 20 г-соединения (IIб) в смеси 400 мл этанола и 100 мл хлористого метилена при перемешивании и комнатной температуре добавляют медленно по каплям смесь 2,5 мл соляной кислоты и 2,5 мл воды (рН 2). По окончании реакции реакционную массу упаривают в вакууме до объема 300 мл. К остатку при перемешивании и комнатной температуре добавляют 600 мл воды. Суспензию охлаждают до температуры 0...+5oC и выдерживают в течение 2 часов. Осадок отфильтровывают, промывают на фильтре водой до рН 7.
Получают 15,5 г соединения (IIа) с выходом 98%, с температурой плавления 232-233oC.
Пример 6. Получение 17  гидрокси-21-иодпрогестерона (VIIa).
гидрокси-21-иодпрогестерона (VIIa).
К раствору 10 г 17  -гидроксипрогестерона (IIа) в 100 мл смеси хлористого метилена и метанола (3:1) добавляют последовательно при комнатной температуре 7,6 г оксида кальция, 0,5 мл воды, 10 г йода и раствор 1,7 г хлорида кальция в 25 мл метанола. Суспензию перемешивают при температуре 25oC в течение часа. Реакционную массу разбавляют 75 мл хлористого метилена и выливают при температуре 0...5oC в раствор 45 г бикарбоната натрия в 540 мл воды. Осадок отфильтровывают, промывают на фильтре хлористым метиленом. Фильтрат переносят в делительную воронку, органический слой отделяют, водный экстрагируют хлористым метиленом. Растворитель упаривают до небольшого объема, осадок отфильтровывают. Получают 13,45 г (98%) 17
-гидроксипрогестерона (IIа) в 100 мл смеси хлористого метилена и метанола (3:1) добавляют последовательно при комнатной температуре 7,6 г оксида кальция, 0,5 мл воды, 10 г йода и раствор 1,7 г хлорида кальция в 25 мл метанола. Суспензию перемешивают при температуре 25oC в течение часа. Реакционную массу разбавляют 75 мл хлористого метилена и выливают при температуре 0...5oC в раствор 45 г бикарбоната натрия в 540 мл воды. Осадок отфильтровывают, промывают на фильтре хлористым метиленом. Фильтрат переносят в делительную воронку, органический слой отделяют, водный экстрагируют хлористым метиленом. Растворитель упаривают до небольшого объема, осадок отфильтровывают. Получают 13,45 г (98%) 17  - гидрокси-21-иодпрогестерона (VIIa) с т.пл. 145oC (с разл.)
- гидрокси-21-иодпрогестерона (VIIa) с т.пл. 145oC (с разл.)
Пример 7. Получение 21-aцетoкcи- 17  гидpoкcипpoгеcтepoнa (I)
гидpoкcипpoгеcтepoнa (I)
К раствору 13,45 г 17  гидрокси-21-иодпрогестерона (VIIa) в 130 мл диметилформамида добавляют 13,5 г плавленого ацетата калия. Суспензию перемешивают 2 часа при температуре 60oC, затем охлаждают, выпавший осадок отфильтровывают, промывают на фильтре водой. Осадок растворяют в хлористом метилене, раствор осветляют углем, упаривают досуха. Остаток кристаллизуют из ацетона. Получают 9,6 г (84%) 21- ацетокси- 17
гидрокси-21-иодпрогестерона (VIIa) в 130 мл диметилформамида добавляют 13,5 г плавленого ацетата калия. Суспензию перемешивают 2 часа при температуре 60oC, затем охлаждают, выпавший осадок отфильтровывают, промывают на фильтре водой. Осадок растворяют в хлористом метилене, раствор осветляют углем, упаривают досуха. Остаток кристаллизуют из ацетона. Получают 9,6 г (84%) 21- ацетокси- 17  -гидроксипрогестерона (I) с т.пл. 239-241oC.
-гидроксипрогестерона (I) с т.пл. 239-241oC.
Способы получения кортикостероидов общей формулы I

где R1 -  - или
- или 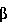 -ОН-группа или атом Н;
-ОН-группа или атом Н;
R2-Н, или ОН, или F, или вместо R1, R2 - двойная связь; R3 - Н, или F, или СН3-группа; R4 - Н или ОН-группа; R5 -  - или
- или 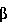 -СН3-группа или атом Н; R6 - Н или Ас, заключающийся в том, что прегнаны общей формулы II
-СН3-группа или атом Н; R6 - Н или Ас, заключающийся в том, что прегнаны общей формулы II

где R7 и R8 вместе кето-группа, или незамещенный, или 2-монозамещенный, или 2,2-дизамещенный пропиленкеталь, подвергают галоидированию С-21 положения с последующим замещением галоида на гидрокси- или ацетокси-группу, отличающийся тем, что для получения прегнанов в качестве исходного соединения используют 3,17 - дикетоандростаны общей формулы III

которые подвергают цианированию, защите 17  -ОН-группы, защите 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя и алкилированию 17 CN-группы с последующим гидролизом.
-ОН-группы, защите 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя и алкилированию 17 CN-группы с последующим гидролизом.
Способ по п.1, отличающийся тем, что галоидирование осуществляют путем прямого иодирования.
Способ по п.1 или 2, отличающийся тем, что для защиты 17  -ОН группы используют алкилвиниловый эфир.
-ОН группы используют алкилвиниловый эфир.
Дата добавления: 2015-09-05; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Кортикостероиды | | | Применение кортикостероидов |