
Читайте также:
|
3-1. Формула средней скорости гомогенной реакции
а) 
| б) 
| в) 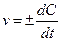
| г) 
|
3-2. Математическая зависимость скорости реакции от температуры описывается
| а) уравнением Аррениуса | г) уравнением Де-Бройля |
| б) уравнением Планка | д) принципом Ле-Шателье |
| в) правилом Вант-Гоффа |
3-3. Уравнение, описывающее зависимость скорости реакции от температуры,
а) 
| в) 
|
б) 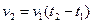
| г) 
|
3-4. Значения температурного коэффициента скорости реакции γ
| а) 2, 3, 4, 5, 6 | г) изменяется от 2 до 8 |
| б) –2, –1, 0, +1, +2 | д) изменяется от –1/2 до + 1/2 |
| в) изменяется от 2 до 4 |
3-5. Измельчение твердого вещества скорость химической реакции
| а) уменьшает | в) не изменяет |
| б) увеличивает | г) замедляет |
3-6. Катализатор скорость химической реакции:
| а) не изменяет | в) уменьшает | д) периодически влияет |
| б) увеличивает | г) замедляет |
3-7. Скорость химической реакции при увеличении концентрации реагирующих веществ:
| а) уменьшается | в) не изменяется |
| б) увеличивается | г)изменяется периодически |
3-8. Скорость химической реакции зависит от
| а) температуры | в) катализатора |
| б) цвета вещества | г) формы реактора |
3-9. Знак минус в уравнении VСР = ±DС/Dt выбирают в том случае, если скорость реакции вычисляют
а) по изменению концентрации исходного вещества
б) по изменению концентрации продукта реакции
в) по изменению площади поверхности реагирующих веществ
г) по изменению температуры при протекании реакции
3-10. Порядок реакции – это сумма показателей степеней в
| а) уравнении Аррениуса | в) выражении закона действующих масс |
| б) уравнении Вант-Гоффа | г) выражении Больцмана |
3-11. Константа скорости химической реакции равна скорости химической реакции при
а) стандартной температуре
б) стандартных концентрациях реагирующих веществ
в) условии необратимости процесса
г) стандартном давлении и температуре
д) стандартном изменении энергии Гиббса
3-12. Катализатор изменяет скорость реакции, потому что
а) удаляет продукты реакции
б) взаимодействует с реагирующими веществами, изменяя энергию активации
в) изменяет температурный коэффициент реакции
г) смещает положение равновесия в сторону прямой реакции
3-13. Скорость обратной химической реакции CaCO3(Т) D CaO(Т) + CO2(Г)
описывается уравнением:
а) 
| в) 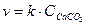
| д) 
|
б) 
| г) 
|
3-14. Температурный коэффициент показывает:
а) во сколько раз изменится скорость реакции при повышении температуры на 10º
б) во сколько раз изменяется концентрация при повышении температуры на 10º
в) во сколько раз увеличивается время протекании реакции при повышении температуры на 10º
г) на сколько градусов изменяется температура при протекании реакции
3-15. Активные молекулы обладают
а) избыточной энергией
б) оптимальной ориентацией в пространстве
в) большой вероятностью столкновения
г) способностью ускорять реакцию
3-16. Константа скорости реакции  зависит от
зависит от
| а) температуры | г) концентрации продуктов реакции |
| б) давления | д) присутствия ингибиторов |
| в) концентрации исходных веществ | е) присутствия катализаторов |
3-17. Константа скорости реакции PCl3(Г) + Cl2(Г) D PCl5(Г) изменится при
| а) увеличении давления в 2 раза | г) повышении температуры |
| б) уменьшении объема в 2 раза | д) увеличении перемешивания |
| в) увеличении концентрации PCl3 |
3-18. Соответствие понятий и математических зависимостей, которые им соответствуют:
| 1) | Закон действующих масс | а) | 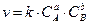
|
| 2) | Уравнение Вант-Гоффа | б) | 
|
| 3) | Уравнение Аррениуса | в) | 
|
| г) | 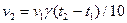
| ||
| д) | 
|
3-19. Предэкспоненциальный множитель в уравнении Аррениуса
а) показывает долю активных столкновений
б) равен константе скорости реакции при стандартных условиях
в) равен максимально возможной константе скорости при данной температуре
г) равен энергии активации
3-20. Закон действующих масс, строго соблюдается для... реакций
| а) гетерогенных | в) параллельных |
| б) последовательных | г) гомогенных |
3-21. Выражение для скорости  соответствует реакции
соответствует реакции
| а) A + B " C | в) A + 2B " C | д) A2B " C + D |
| б) 2A + B " C | г) 2A + 2B " 2C |
3-22. Скорость прямой реакции CO2(Г) + СТВ " 2CO(Г)..., если увеличить давление в 2 раза.
| а) увеличится в 4 раза | в) увеличится в 2 раза |
| б) увеличится в 16 раз | г) уменьшится в 2 раза |
3-23. Скорость обратной реакции CO2(Г) + СТВ " 2CO(Г)..., если увеличить давление в 2 раза.
| а) увеличится в 4 раза | в) увеличится в 2 раза |
| б) Увеличится в 16 раз | г) уменьшится в 2 раза |
3-24. Температуру надо..., для того чтобы скорость реакции
CO2(Г) + СТВ " 2CO(Г) увеличилась в 32 раза (температурный коэффициент 2).
| а) повысить на 32º | г) повысить на 50º |
| б) повысить в 32 раза | д) повысить на 100º |
| в) повысить на 64º |
3-25. Скорость реакции N2 + 3H2 " 2NH3...., если концентрацию азота увеличить в 4 раза и концентрацию водорода – в 2 раза.
| а) возрастает в 32 раза | в) увеличивается в 20 раз |
| б) увеличивается в 24 раза | г) возрастает в 8 раз |
3-26. Скорость реакции 4HCl(Г) + O2(Г) " 2Cl2(Г) + 2H2O(Г)... при увеличении давления в 3 раза.
| а) увеличится в 3 раза | в) увеличится в 243 раза |
| б) возрастет в 81 раз | г) не изменится |
3-27. Смещение положение химического равновесия описывает
а) закон сохранения массы веществ М.В.Ломоносова
б) принцип Ле-Шателье
в) периодический закон Д.И.Менделеева
г) правило Вант-Гоффа
д) уравнение Аррениуса
е) 1-й закон термодинамики
3-28. Положение химического равновесия зависит от
| а) температуры | г) перемешивания |
| б) концентрации реагирующих веществ | д) катализатора |
| в) цвета веществ | е) индикатора |
3-29. Обратимая реакция
| а) A + B = AB | в) A + B! AB |
| б) A + B AB | г) A + B D AB |
3-30. Общий вид выражения для константы равновесия для реакции, уравнение которой Aa + Bb D dD + pP:
а) 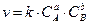
| г) 
|
б) 
| д) 
|
в) 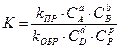
|
3-31. Совокупность однородных (по химическим и физическим свойствам) частей системы называется
| а) энтропией | г) фазой |
| б) энтальпией | д) раствором |
| в) структурой |
3-32. Химическое равновесие – это такое состояние системы, когда
а) скорость прямой реакции больше скорости обратной реакции
б) скорость прямой реакции меньше скорости обратной реакции
в) скорость прямой реакции равна скорости обратной реакции
г) реакция протекает лишь в одном направлении
3-33. Реакции, в результате протекания которых выпадает осадок, выделяется газ или образуется малодиссоцирующее вещество, называются
| а) обратимыми | в) равновесными |
| б) необратимыми | г) неравновесными |
3-34. Рисунок, изображающий состояние равновесия:
| а) | 
| в) | 
|
| б) | 
| г) | 
|
3-35. Кинетическое условие равновесия системы A + B D AB:
а) 
| в) 
| д) 
|
б) 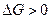
| г) 
| е) 
|
3-36. Термодинамическое условие равновесия системы A + B D AB:
а) 
| в) 
| д) 
|
б) 
| г) 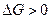
| е) 
|
3-37. Принцип Ле-Шателье: если на систему, которая находится в состоянии равновесия, оказать внешнее воздействие, то положение равновесия сместится в сторону
а) той реакции, которая ослабляет это воздействие
б) той реакции, которая усиливает это воздействие
в) прямой реакции
г) обратной реакции
3-38. Положение равновесия смещено в сторону... реакции при KP > 1.
| а) прямой | в) равновесной |
| б) обратной | г) обратимой |
3-39. Положение равновесия смещено в сторону... реакции при KP < 1.
| а) прямой реакции | в) равновесной реакции |
| б) обратной реакции | г) обратимой реакции |
3-40. Выражение константы равновесия системы
CH4(Г) + CO2(Г) D 2CO(Г) +2H2(Г) :
а) 
| в) 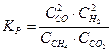
|
б) 
| г) 
|
3-41. Выражение константы равновесия системы 2H2S(Г) D 2H2(Г) + S2(Т):
а) 
| в) 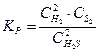
|
б) 
| г) 
|
3-42. Положение равновесия системы 2NO2(Г) D 2NO(Г) + O2(Г) зависит от
| а) давления | в) увеличения концентрации NO2 |
| б) добавления катализатора | г) изменения температуры |
3-43. Повышение температуры вызовет смещение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж/моль
а) в сторону обратной реакции
б) в сторону прямой реакции
в) не сместит равновесие
г) увеличит количество образующихся веществ.
д) уменьшит количество образующихся веществ.
3-44. Константа равновесия имеет вид 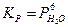 для системы:
для системы:
а) 3O2(Г) + 12HCl(Г) D 6H2O(ПАР) + 3Cl2(Г)
б) 6Cl2(Г) + 6H2O(Ж) D 6HCl(Ж) + 6HClO(Ж)
в) 6Na(Т) + 6H2O(Ж) D 6NaOH(Т) + 3H2(Г)
г) CaCl2×6H2O(Т) D CaCl2(Т) + 6H2O(ПАР)
3-45. Влево будут смещать положение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж.
| а) уменьшение давления | г) повышение температуры |
| б) понижение температуры | д) уменьшение концентрации NO |
| в) повышение давления | е) увеличение концентрации NO |
3-46. Давление не будет изменять положение равновесия в системе:
| а) N2(Г) + O2(Г) D 2NO(Г) | в) 2NO2(Г) D 2NO(Г) + O2(Г) |
| б) 3O2(Г) + 12HCl(Г) D 6H2O(ПАР) + 3Cl2(Г) | г) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г) |
3-47. Положение равновесия системы MgCO3(Т) D MgO(Т) + CO2(Г); DH > 0 будет смещаться при повышении температуры
| а) в сторону исходных веществ | в) влево |
| б) в сторону продуктов реакции | г) не будет изменять своего положения |
3-48. Соответствие между обозначениями в формуле  и их физическим смыслом
и их физическим смыслом
| 1) С | а) число степеней свободы системы |
| 2) Ф | б) число фаз в системе |
| 3) К | в) число компонентов |
| 4) 2 | г) число влияющих внешних факторов |
| д) концентрацияфизическая постоянная | |
| е) элемент калий |
3-49. Соответствие между воздействием на систему
H2(Г) + S(Т) D H2S(Г); DH < 0 и направлением смещения равновесия.
| 1) повышение температуры | а) в сторону обратной реакции |
| 2) уменьшение концентрации H2S | б) в сторону прямой реакции |
| 3) увеличение давления | в) положение равновесия не изменяется |
| г) сера выпадает в осадок |
3-50. Константа равновесия системы 2NO2 D 2NO + O2 при равновесных концентрациях  ,
,  ,
,  равна
равна
| а) 0,1152 | б) 0,48 | в) 1,92 | г) 5,21 |
3-51. Константа равновесия гомогенной системы A + B D 2С при равновесных концентрациях  ,
,  ,
,  равна
равна
| а) 56,41 | г) 0,36 |
| б) 49,64 | д) 42 |
| в) 0,018 |
3-52. Повышение температуры сместит положение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж. В ту же сторону, что и
| а) понижение давления | в) повышение концентрации NO |
| б) повышение давления | г) понижение концентрации NO |
Дата добавления: 2015-08-27; просмотров: 66 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тема 2. Термодинамика и направленность химических реакций. | | | Тема 4. Строение атома. Периодическая система. |