
Читайте также:
|
Состояние газа характеризуется основными термодинамическими параметрами: давлением, объемом и температурой. Связь между этими параметрами (уравнение объединенного закона газового состояния) для определенной массы газа определяется следствием из основного уравнения молекулярно-кинетической теории:
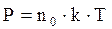
| (1.1) |
где
Р - давление газа, Па;
k = 1,38·10 -23 Дж/К - постоянная Больцмана;
Т - термодинамическая температура, К;
n - число молекул в единице объема (концентрация молекул газа):
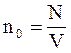
| (1.2) |
где
N - общее число молекул;
V - объем газа, м3.
Тогда подставим (1.2) в (1.1):
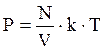 или
или

| (1.3) |
Очевидно, что для данной массы газа (т.е. при m = сonst) общее число молекул N и постоянная Больцмана k - неизменны, то и произведение этих величин тоже неизменная величина: N·k=const. Из соотношения (1.3) получаем уравнение объединенного закона газового состояния:
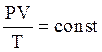
| (1.4) |
Таким образом, объединенный газовый закон (1.4) можно сформулировать следующим образом:
| Для данной массы газа произведение давления на объем, деленное на термодинамическую температуру газа, есть величина постоянная для всех состояний этой массы газа. |
Рассмотрим два состояния одного газа:
в начале процесса (первое состояние) численные значения параметров газа обозначим через P1,V1,T1, а параметры во втором состоянии обозначим - через Р2, V2, Т2.
Применим объединенный газовый закон (1.4.) для двух состояний, тогда:
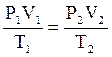
| (1.5) |
1 ОБОРУДОВАНИЕ
2.1 Барометр-анероид (для общего пользования).
2.2 Масляный манометр.
2.3 Термометр.
2.4 Стакан химический с горячей водой.
3 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной лабораторной работе для проверки объединенного газового закона (1.5) необходимо определить термодинамические параметры газа - давление Ргаза, температуру Т газа и объем Vгаза в двух состояниях:
1) Р1, Т1, V1 - при комнатной температуре и
2) Р2, Т2, V2 - при повышенной температуре
Следовательно, необходимо провести два опыта при двух температурах.
Дата добавления: 2015-08-26; просмотров: 213 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| К ВЫПОЛНЕНИЮ ЛАБОРАТОРНОЙ РАБОТЫ | | | Описание масляного манометра |