
Читайте также:
|
Элемент главной подгруппы VI Группы, второго периода периодической системы химических элементов Менделеева, с атомным номером 8.
Самый распространённый на Земле элемент, на его долю(в составе различных соединений, главным образом силикатов) приходится около 47.4% массы твёрдой ЗК. Морские и пресные воды содержат огромное количество связанного кислорода - 88.8%(по массе),. в атмосфере содержание свободного кислорода составляет 20.95% по объёму и 23.12% по массе. Более 1500 соединений ЗК в своём составе содержат кислород. Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25% по массовой доле - около 65%.
О2- определяет кислотность – основность.
На других планетах О2 нет, он образует в основном оксиды и другие кислородные соединения. ~4 тыс. минералов О. В магматических процессах- влияние на структуру силикатных расплавов, активности О2 определяет свойства силикатных расплавов.
SiO2 + O2 –> SiO42- (кислоты)
MgO –> Mg2+ +О2- (основания) => по Коржинскому рО – мера основности. fO2 определяется реакциями.
кислородные буферы: HM (гематит-магнетит) 2Fe3O4+1/2O2 = 3Fe2O3
NNO (Ni-NiO) Ni+1/2O2 = NiO
QFM (кварц-фаялит-магнетит) 3Fe2SiO4+O2 = 2Fe3O4+3SiO2
WM (вюстит-магнетит) 3FeO+1/2O2 = Fe3O4
IW (железо-вюстит) Fe+1/2O2 = FeO
в магм породах содержание кислорода увеличивается от гипербазитов к кислым породам, т к MgO концентрирует 1 атом, а SiO2 - 2атома O
Изотопы: 16 О, 17 О, 18 О, легкий элемент.

16O-99.76%(наиболее легкий и самый распространённый), 17O-0.039%(меньше всего), 18O- 0.202%. Изотопы широко фракционируют.
Отношение изотопов SMOW 16O/18O = 500.1 (изменения только в последнем знаке). Поэтому взят стандарт - coотношение в морской воде (SMOW).
 18О= ((18О/16О)обр / (18O/16O)SMOW -1)*1000%о
18О= ((18О/16О)обр / (18O/16O)SMOW -1)*1000%о
Масс-независимое фракционирование изотопов:
О2 (под воздействием УФ) –> 3О (17О 18О 16О). Аномалии 17О – маркер: в атмосфере есть озон => есть кислород.
Мантия: +5,6%о отн. SMOW
 *Здесь должна быть Диаграмма Тейлора*- изменение состава вод по линии Крейга (см.вопр 47)
*Здесь должна быть Диаграмма Тейлора*- изменение состава вод по линии Крейга (см.вопр 47)
опалы максимально обогащены тяжелыми изотопами
22. Геохимия брома. Cl/Br коэффициент.
Бром распространён меньше, чем хлор, его кларк около 10^(-4)%. Часто бром ведет себя как аналог хлора, выделено всего 6 минералов брома, хотя изоморфизм Cl-Br не всегда полный. Есть исключение AgBr – бромаргерит, хуже растворим, чем AgCl – аргерит. Примерно 75% всего Br находится в океане. У брома два изотопа 75 и 81 их по 50,69 и 42,91 соответственно. Br избыточно летучий.
Важным является отношение Cl/Br (здесь большее делят на меньшее): для метеоритов =197, для земной коры =110, для океана =286,4. Т.е. бром меньше накапливается в океане и больше на континенте, чем хлор. Это отношение позволяет различать происхождение вод. Что важно при отработке соляных месторождений, если значение отношения около 300, то это остаточный рассол. ЕСЛИ Cl/Br < 300 признак участия остаточных рассолов, если больше, то это рассолы ващелачивания (растворение галита), надо бить тревогу.

Бром может выделяться в вулканических газах, накапливаться в морской воде, выветривается из неё. Может быть в газовой фазе Br2Ю, что можно понять по соотношению Br/Cl в дождях.
Бром является биофильным элементом, накапливается в организме, только Br2 является ядом.
23. Роль С в биосфере. Геохимия угля, нефтей, битумов. Цикл С. 14С и его значение для геохимических исследований.
Разумеется с С связан процесс фотосинтеза: H2O+CO2⇌CH2O+O2↑. Часть органического вещества захаранивается в осадках. # Кераген,сложная молекула, размер которой больше 200 дальтон.
Фульва и гуминновые кислоты - продукты переработки органического в-ва. Образуются на маргинальном барьере, а потом переходят в кераген 
Во время извержения много восставовленных газов и при QFM буфере в базальтах и … образуется СН 4
Парниковый эффект - атмосфера поглащает и/к излучения
Цикл СО2
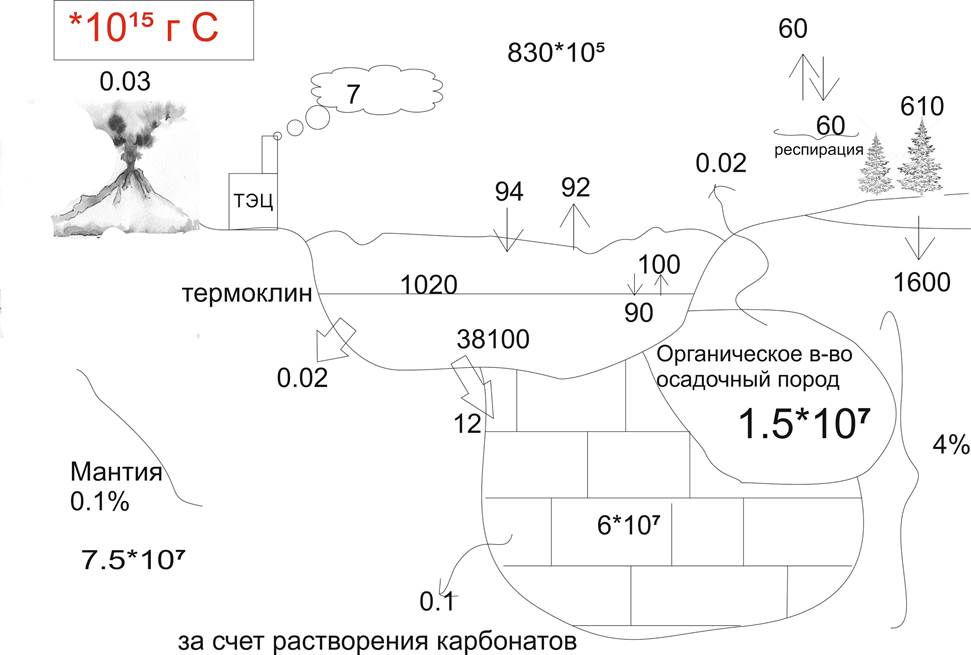
Океан - источник углекисоты.
СаСО3+СО2+Н2О=>Са2++2НСО3
14С путем ß распада до 14N за 5730 лет, объектом исследования служит древесина, кости в пределах 70 тыс. лет
Калибруют на 5 тыс. лет по секвойе
В атмосфере такое соотношение, первый пик подбросил в 10 тыс. разве выше нормы.
 график 3T -год
график 3T -год
Распространение С подчиняется солнечным циклам. А активность на солнце связана с пятнами. Чем больше пятен, тем больше солнечного ветра и меньше ядерных реакций на Земле.
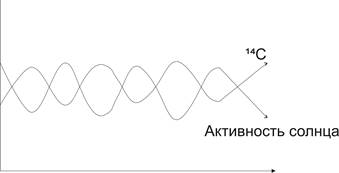
Калибровочный график для 14С нелинейный и сложный, современную шкалу строят по кораллам.

Дата добавления: 2015-08-17; просмотров: 195 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Геохимия Th. | | | Геохимия индия. Пути концентрации и рассеяния индия в процессах. |