
Читайте также:
|
По мере их сближения потенциальная энергия возрастает – находящиеся на наружных орбиталях оболочки валентные электроны обоих атомов отталкиваются друг от друга. Если кинетическая энергия сближения этих атомов мала – меньше энергии активации WA (максимальной потенциальной энергии взаимодействия), атомы спустя некоторое время начинают расходиться. Во множестве большого числа таких атомов это постоянное сближение и расхождение частиц ничем не отличается от процесса хаотического движения внутри идеального газа, рассмотренного в § 3.1.
Если же кинетическая энергия движения атомов больше максимума WA, их центры масс сходятся на расстоянии, меньше rкр, соответствующего энергии активации. Атомы “сваливаются” в совместную потенциальную яму и оказываются прочными соединенными друг с другом. Для того, чтобы их взаимная кинетическая энергия Wk была больше WA, множество атомов должно быть нагрето до температуры T0p> соответствующей T0a:
 (12.12)
(12.12)
где KБ – постоянная Больцмана.
Добавление в смесь, состоящую из двух типов объединяющихся атомов, небольшого количества другого вещества (именуемого катализатором) может уменьшить величину WA до WA.K < WA (см. рис. 12.4). Такое явление именуется катализом. Оно лежит в основе процесса управления химическими реакциями.
После объединения атомов в молекулу в окружающее пространство излучается электромагнитная энергия Wэ.м равная W1 – W2, где W2 – потенциальная энергия атомов в связанном состоянии, а W1 – их энергия до объединения (см. рис. 12.4). Кинетическая энергия атомов Wк превращается частично в кинетическую энергию движения молекулы, частично в кинетическую энергию вращения молекулы вокруг своего центра масс и колебательного движения ядер атомов внутри молекулы (см. главу третью). Излученная электромагнитная энергия вместе с кинетической энергией движения молекулы передается другим атомам смеси, инициируя их объединение в молекулы. Таким образом, процесс объединения атомов в молекулу принимает непрерывный характер и именуется химической реакцией. Часть Wэ.м выходит за пределы объема, в котором протекает химическая реакция, превращаясь в тепловую энергию, нагревающую окружающую среду. Если умножить Wэ.м на число частиц, вступивших в реакцию, то мы получим энтальпию Н. Эта энергия расходуется на создание внутренней энергии реагирующих частиц (т.е. энергию их теплового, хаотического движения Wвн), излучаемую во внешнюю среду свободную энергию Wс и на работу по расширению объема массы атомов, вступивших в реакцию, - pV:
H=Wвн+Wc+pV. (12.13)
Величина Wc именуется свободной энергией Гельмгольца WGg, а сумма (Wc+pV) – свободной энергией Гиббса WG. Обе эти величины показывают, какое количество тепловой энергии излучается данным объемом реагирующих веществ в окружающую среду при изменении их объема (WGg) или при неизменном объеме (WG).
Все сказанное выше относится не только к объединению в одну молекулу двух атомов, но и для более сложных видов химических реакций. Только среди этих последних возможны ситуации, когда разность (W1-W2)<0, т.е. для протекания реакции в зону, где она происходит, извне необходимо постоянно подводить тепловую энергию. Ясно, что энтальпия процессов имеет противоположный знак. Именуются они эндотермическими в отличие от первых – экзотермических.
Связи атомов в молекулах бывают четырех видов: ковалентная, ионная, металлическая и Ван-дер-Ваальса.
Ковалентная связь характеризуется тем, что два или более атомов объединяют один или более своих валентных электронов. Эти электроны движутся по орбиталям, принадлежащим всем входящим в молекулу атомам.
Ионная связь характеризуется тем, что атом одного элемента присоединяет к себе валентный электрон другого атома. Такое происходит с теми веществами, энергия связи валентных электронов которых со своими ядрами разная. При сближении этих атомов – антиподов валентный электрон покидает оболочку того ядра, с которым он слабо связан и присоединяется к тому, связь наружной оболочки которого больше (разумеется, если в ней есть вакансии – см. § 12.2). В результате возникают два иона – положительный (с отсутствующим электроном) и отрицательный, которые притягиваются друг к другу в соответствии с законом Кулона.
Металлическая связь возникает вследствие того, что у металлов энергия наружных орбиталей нескольких соседних атомов сливаются друг с другом и соответствующие валентные электроны блуждают по всему объему, принадлежа одновременно всем его атомам. Эта связь обеспечивает высокую прочность материала и его пластичность.
Связь Ван-дер-Ваальса обусловлена диполь - дипольным взаимоздействием, т. е. возникает между молекулами с несимметричным расположением зарядов. На рис. 12.5 показано, как могут появится связи Ван-дер-Ваальса между молекулами воды. В этих молекулах один из атомов водорода имеет положительный заряд – его электрон отобрал атом кислорода. В результате молекулы объединяются в полимолекулу (H2O)n. Конфигурация полимолекулы во многом определяется начальными условиями ее формирования. Силы Ван-дер-Ваальса являются самыми слабыми из всех формирующих молекулы.
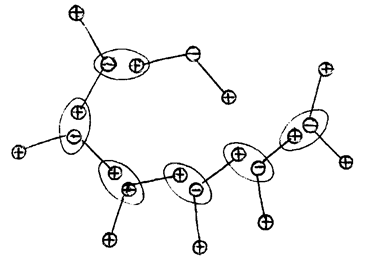
Рис. 12.5. Образование макромолекулы воды под действием сил Ван-дер-Ваальса
Дата добавления: 2015-08-17; просмотров: 150 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Формирование молекулярных структур | | | Агрегатные состояния вещества |