
Читайте также:
|
Автопротолизу подвергаются амфотерные растворители.
Если ве-во взято в кач.растворителя, то в зависимости от того, какая тенденция отдача или присоединение протона у него преобладает, то оно может различным образом влиять на ионизацию растворенного ве-ва.
Автопротолиз растворителей протекает в незначит.степени, в р-ре наступает арвновесие кот.описывается константой:
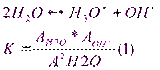
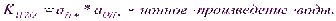
это важнейшее выражение, свидетельствующее о том, что в любом р-ре имеются как ионы водорода, таки гидроксид ионы.
Реакция среды: рН=-lgaH+
рН=7 в нейтральном р-ре,
рН<7 в кислом
pH>7 в щелочном.
Анологично водородному опр-т гидроксильный показатель рОН= lgaОН+
А выр-е часто записывают в логарифмич.форме: рН+рОН=14
Дата добавления: 2015-08-17; просмотров: 115 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Концентрация и активность. Ионная сила раствора. | | | Равновесие в водных растворах сильных и слабых кислот и оснований. Расчет рН. |