
|
Читайте также: |
Пример 1. Кислород массой m = 2 кг занимает объем V 1 = 1 м3 и находится под давлением P 1 = 0,2 МПа. После нагревания при постоянном давлении он занял объем V 2 = 3 м3, а затем его давление в ходе изохорического процесса стало равным P 3 = 0,5 МПа. Найти изменение внутренней энергии газа D U, совершенную им работу A и количество теплоты Q, переданной газу. Построить график процесса.
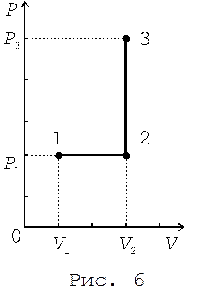 Решение. График процесса приведен на рис. 6.
Решение. График процесса приведен на рис. 6.
Работа расширения газа A 12 при изобарическом переходе из состояния 1 в состояние 2 вычисляется по формуле

Работа газа A 23 при изо-хорическом переходе из сос-тояния 2 в состояние 3 равна нулю.
Таким образом, полная работа A, совершаемая газом при переходе из состояния 1 в состояние 3, равна
 .
.
Изменение внутренней энергии газа при переходе 1®2®3 определяется соотношением
 (1)
(1)
где i - число степеней свободы газа;
T 1 и T 3 - температура газа соответственно в начальном и конечном состояниях.
Уравнения Менделеева - Клапейрона для состояний 1 и 3 запишутся в виде
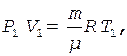 (2)
(2)
 (3)
(3)
После совместного решения уравнений (1)-(3) получим выражение для изменения внутренней энергии газа:

Согласно первому началу термодинамики, теплота Q, переданная газу, расходуется на совершение газом работы и на изменение его внутренней энергии:
Q = A + D1 U.
Произведем вычисления, учитывая, что для двухатомных молекул кислорода 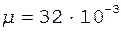 кг/моль, а число степеней свободы i = 5:
кг/моль, а число степеней свободы i = 5:
A = A 12 = 0,2 × 106 × (3 - 1) = 0,4 × 106 Дж = 0,4 МДж;
 × МДж;
× МДж;
Q = (3,25 + 0,4) = 3,65 МДж.
Пример 2. Тепловой двигатель, работающий по циклу Карно, получает тепло от нагревателя при температуре 227 °С в количечтве Q1=5 кДж за цикл и передает часть его окружающему воздуху. При этом двигатель совершает за цикл работу, равную 2 кДж.
С каким к.п.д. работает двигатель? Какова температура окружающего воздуха и как изменяется его энтропия за счет работы двигателя в течении одного цикла?
Р е ш е н и е. Коэффициент полезного действия двигателя, работающего по циклу Карно, равен
 (1)
(1)
где Q 2 - тепло, передаваемое двигателем холо-дильнику (окружающей среде);
A - работа;
Т 2 – температура холодильника (окружающей среды - воздуха);
Т 1 - температура нагревателя.
Отсюда к.п.д.:
 .
.
Температура окружающей среды (Т1 =227+273=500К):
Т2=Т1(1-h)= 500(1-0,4)=300К=270С.
Изменение энтропии окружающей среды определим по формуле Клаузиуса:
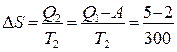 =0,01кДж/К=10Дж/К.
=0,01кДж/К=10Дж/К.
Заметим, что энтропия окружающей среды возрастает, так как она получает тепло от теплового двигателя.
Дата добавления: 2015-08-02; просмотров: 77 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Молекулярная физика (№№ 201-230) | | | Электростатика |