
Читайте также:
|
Химические свойства йодида калия
1. KI ↔ K+ + I-, pH = 7
2. KI(тв.) + H2SO4 ( конц) → K2SO4 + I2↓ + H2S↑ + H2O
3. KI + HNO3 ( конц) → KNO3 + NO2↑ + I2↓ + H2O
. KI + HNO3 ( конц) → KIO3 + NO2↑ + H2O
4. KI + AgNO3 → AgI↓ + KNO3
5. KI + HgI2 → K2[HgI4]
6. KI + FeCl3 → FeCl2 + I2↓ + KCl
7. KI + CuSO4 → CuI↓ + I2↓ + K2SO4
8. KI + Г2 → I2↓ + KГ (Г = Cl2, Br2, F2)
KI + Cl2 + KOH → KIO3 + KCl + H2O
9. KI + KMnO4 + H2SO4 → I2↓ + MnSO4 + K2SO4 + H2O
KI + K2Cr2O7 + H2SO4 → I2↓ + Cr2(SO4)3 + K2SO4 + H2O
KI(тв.) + MnO2 + H2SO4(конц.) → I2↓ + MnSO4 + K2SO4 + H2O
KI(тв.) + PbO2 + H2SO4(конц.) → I2↓ + PbSO4 + K2SO4 + H2O
10. KI + KNO2 + H2SO4 → I2↓ + NO↑ + K2SO4 + H2O
KI + NO2 + H2SO4 → I2↓ + NO↑ + K2SO4 + H2O
11. KI + H2O2 + H2SO4 → I2↓ + K2SO4 + H2O
12. KI + I2 → KI3 (K[I(I2)])
13. KI + H2O 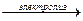 KOH + H2↑ + I2↓
KOH + H2↑ + I2↓
14. KI + H2O 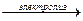 KIO3 + H2↑
KIO3 + H2↑
Химические свойства йодида калия
1. KI ↔ K+ + I-, pH = 7
2. KI(тв.) + H2SO4 ( конц) → K2SO4 + I2↓ + H2S↑ + H2O
3. KI + HNO3 ( конц) → KNO3 + NO2↑ + I2↓ + H2O
. KI + HNO3 ( конц) → KIO3 + NO2↑ + H2O
4. KI + AgNO3 → AgI↓ + KNO3
5. KI + HgI2 → K2[HgI4]
6. KI + FeCl3 → FeCl2 + I2↓ + KCl
7. KI + CuSO4 → CuI↓ + I2↓ + K2SO4
8. KI + Г2 → I2↓ + KГ (Г = Cl2, Br2, F2)
KI + Cl2 + KOH → KIO3 + KCl + H2O
9. KI + KMnO4 + H2SO4 → I2↓ + MnSO4 + K2SO4 + H2O
KI + K2Cr2O7 + H2SO4 → I2↓ + Cr2(SO4)3 + K2SO4 + H2O
KI(тв.) + MnO2 + H2SO4(конц.) → I2↓ + MnSO4 + K2SO4 + H2O
KI(тв.) + PbO2 + H2SO4(конц.) → I2↓ + PbSO4 + K2SO4 + H2O
10. KI + KNO2 + H2SO4 → I2↓ + NO↑ + K2SO4 + H2O
KI + NO2 + H2SO4 → I2↓ + NO↑ + K2SO4 + H2O
11. KI + H2O2 + H2SO4 → I2↓ + K2SO4 + H2O
12. KI + I2 → KI3 (K[I(I2)])
13. KI + H2O 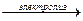 KOH + H2↑ + I2↓
KOH + H2↑ + I2↓
14. KI + H2O 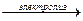 KIO3 + H2↑
KIO3 + H2↑
Дата добавления: 2015-08-10; просмотров: 186 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ячеистая модель | | | Химические свойства йодида калия |