
Читайте также:
|
Структурным элементом, оказывающим значительное влияние на свойства многих веществ, является водородная связь. При определённых условиях атом водорода может быть связан довольно прочно с двумя др. атомами. Имея лишь одну стабильную орбиталь, атом водорода способен образовывать только одну ковалентную связь. Если эта связь полярна, она может, однако, резонировать между двумя положениями.
Связь атома водорода, связанного полярной ковалентной связью с атомом высоко электроотрицательного элемента с другим атомом высоко электроотрицательного элемента называется водородной.
Наибольшее значение имеют те водородные связи, которые образуются между двумя сильно электроотрицательными атомами, в особенности между атомами азота, кислорода и фтора.
Механизм образования водородной связи – донорно-акцепторный. Донор – молекула или ион, имеющий неподеленную пару электронов. Акцептор – протон (Н+).
В некоторых соединениях, таких, как ион FHF-, атом водорода находится приблизительно посредине между двумя электроотрицательными атомами, образуя половину связи с каждым из них. Большинство же водородных связей несимметричны, одно межатомное расстояние больше другого на 50-80 пм, что соответствует отношению прочностей связи, равному приблизительно 10. Энергия более слабой связи обычно составляет около 20-100 кдж×моль-1, что и называется энергией водородной связи.
Водородные связи, образуемые молекулами воды, обусловливают удивительно высокие точки плавления льда и кипения воды, существование максимума плотности воды, расширение воды при замерзании. При таянии льда разрывается только часть этих связей, а полностью они исчезают в парообразном состоянии. Многие особые свойства неорганических и органических молекул, например димеризация жирных кислот, объясняются образованием водородных связей. Водородная связь - особенно важная структурная особенность белков и нуклеиновых кислот.
Ковалентные связи изображают короткими сплошными линиями, а водородные – более длинными пунктирными.
Ее образование обусловленно тем, что в результате сильного смещения общей электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородная связь примерно в 15 – 20 раз слабее ковалентной. Водородные связи могут быть внутри - и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне:
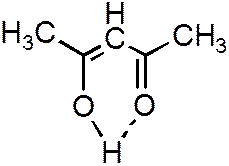
Рисунок 3.3.
Образование внутримолекулярной водородной связи.
H - O....H - O
| |
H H
(H2O)2
Рисунок 3.4.
Образование межмолекулярной водородной связи между молекулами воды.
От величины межмолекулярной водородной связи зависит температура кипения вещества. Внутримолекулярная водородная связь не влияет на значение его температуры кипения.
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. Так, фтористоводородная кислота (HF) является слабой кислотой в отличие от других галогенводородных кислот за счет водородной связи она димеризуется (H2F2) и может образовать кислые соли (NaHF2). За счет водородных связей вода характеризуется столь высокими по сравнению с водородными соединениями других элементов (электронных аналогов) главной подгруппы шестой группы температурами плавления и кипения:
| соединение | Н2Te | Н2Se | H2S | Н2О |
| Tкип.0С | -2 | -42 | -60 |
Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H2O)2, (Н2O)3 и т. д. В растворах же могут возникать длинные цепи ассоциатов такого вида (водородные связи обозначены на рисунке черным цветом):
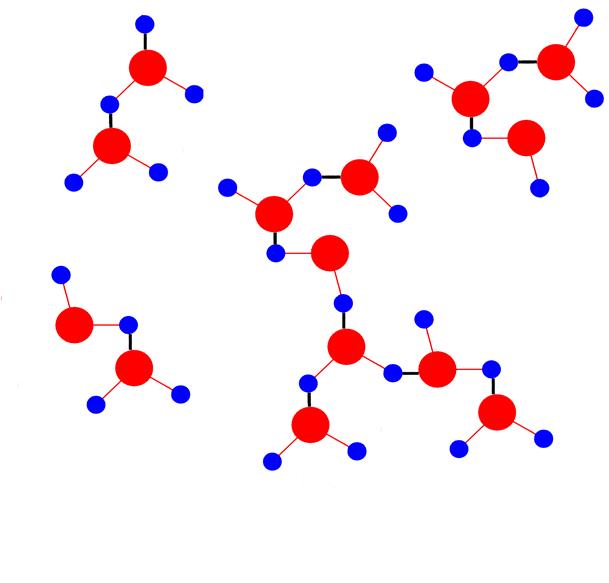
поскольку атом кислорода имеет две неподеленные пары электронов.
Таким образом, водородные связи могут образовываться, если есть полярная Х—Н связь и свободная пара электронов. Например, молекулы органических соединений, содержащие группы —ОН, —СООН, —CONH2, —NH2 и др., часто ассоциированы вследствие! образования водородных связей.
Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусycной кислоты, измеренная по плотности пара, оказывается удвоенной (120 вместо 60).
O....H - O
// \
CH3 - C C - CH3
\ //
O - H....O
(CH3COOH)2
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. По-видимому, наиболее важным и, несомненно, одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями.
Дата добавления: 2015-08-10; просмотров: 102 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Sp-Гибридизованное состояние свойственно атому, если сумма числа связанных с ним атомов и числа его неподеленных электронных пар равна 2 | | | Межмолекулярное взаимодействие |