
|
Читайте также: |
Кулонометрическое титрование отличается большей чувствительностью, чем все другие известные титриметрические методы.
2.4.3. Аппаратура. Для поддержания постоянного потенциала рабочего электрода в потенциостатической кулонометрии могут быть использованы потенциостаты П-5848 и П-5672М, хроноамперометрическая система CXA-1, 1 или простейшая потенциостатическая схема (см. рис.40). Для поддержания постоянной величины тока в амперостатической. кулонометрии могут быть использованы универсальные источники питания УИП-1 и УМП-2, указанные выше потенциостаты П-5848 и П-6672М, поскольку они могут работать как в потенциостатическом, так и в гальваностатическом режимах, или простейшие гальваностатические схемы (см. рис.41).
При использовании потенциостатов электрохимическая ячейка содержит три электрода: рабочий, вспомогательный и электрод сравнения (каломельный или хлорсеребряный). Потенциал рабочего электрода измеряется относительно электрода сравнения и автоматически поддерживается на заданном уровне электронной схемой прибора.
По сравнению с другими физико-химическими методами кулонометрический анализ обладает рядом преимуществ:
- возможностью определения различных веществ в широком диапазоне концентраций;
- высокой точностью и воспроизводимостью;
- высокой чувствительностью (можно определить 10-10 моля вещества);
- возможностью селективного определения веществ в их смеси.
2.5. Электрогравиметрия. Электрогравиметрический анализ основан на использовании электролиза. Суть этого метода состоит в выделении из растворов электролитов металлов (например, меди из раствора сульфата меди), осаждающихся на катоде при прохождении через электрохимическую ячейку постоянного электрического тока. Масса выделившегося на катоде металла соответствует его содержанию в растворе.
Электрогравиметрический анализ можно проводить как при постоянной силе тока, так и при постоянном потенциале рабочего электрода.
Следует иметь в виду, что в первом случав (i = const) в ходе анализа могут возникнуть осложнения, обусловленные следующими обстоятельствами. Как известно, внешнее напряжение, приложенное к электродам электролитической ячейки, описывается уравнением (28):

В процессе электролиза слагаемые правой части уравнения (28) изменяются во времени - вследствие уменьшения концентрации определяемых ионов в растворе электролита его сопротивление будет возрастать, а ток - уменьшаться. Для того, чтобы поддерживать ток постоянным, необходимо непрерывно увеличивать напряжение. Но при любом изменении Е изменяются анодный (φa) и катодный (φK) потенциалы. В результате может наступить такой момент, когда на рабочем электроде начнет осаждаться другой элемент.
Электролиз при постоянном приложенном извне напряжении (E=const) обеспечивает большую селективность анализа, чем при постоянной силе тока, т.к. величину E можно поддерживать достаточно малой. Однако при этом ток электролиза будет мал, и анализ окажется продолжительным. Данное затруднение можно устранить, если проводить электролиз с контролируемым потенциалом рабочего электрода (φк -const), что обеспечивает не только селективность анализа, но и возможно наибольший в условиях данного анализа ток электролиза. Постоянство потенциала рабочего электрода, поддерживают с помощью потенциостата. Схема установки для электрогравиметрического анализа приведена на рис.42.

Рис.42. Схема установки для электроосаждения металлов:
1- источник постоянного тока; 2- реостат; 3- вольтметр; 4- амперметр;
5- электролизер; 6- катод; 7- анод
Электролизер 5 представляет собой обычный химический стакан, в который опущено 2 электрода: большой катод в виде платиновой сетки 6 и меньшего размера анод в виде платиновой спирали 7. Раствор во время электролиза необходимо перемешивать.
Интересной разновидностью электрогравиметрического метода анализа является метод внутреннего электролиза. Метод назван так потому, что его применение не требует внешнего источника электрической энергии. Электрический ток в этом случае возникает за счет работы гальванического элемента, состоящего из платинового катода и анода, металл которого подбирается таким образом, чтобы при погружении этих электродов в исследуемый раствор возникла разность потенциалов. Если в качестве анода взять, например, металлический цинк, то образуется гальванический элемент
Pt | CuSO4 || ZnSO4 | Zn
C4 C1
На платиновом катоде восстанавливается определяемый металл
(Cu2+ + 2e Þ Cu0),
а на аноде растворяется эквивалентное количество цинка:
(Zn0 – 2e Þ Zn2+).
До установления равновесия токообразующей реакции
Cu2+ Zn0 Û Cu0 + Zn2+
практически вся медь будет количественно выделена на платиновом катоде.
Метод внутреннего электролиза прост, так как не требует внешнего источника тока, и селективен.
При проведении электрогравиметрического анализа должны соблюдаться определенные требования:
- определяемое вещество должно выделяться на катоде количественно;
- полученный осадок должен быть однородным по составу (содержание соосажденвых примесей должно быть минимальным);
- осадок должен быть мелкозернистым и плотно сцепленным с поверхностью электрода.
2.6. Кондуктометрия. Кондуктометрические методы анализа просты, практически очень удобны, достаточно точны и позволяют решить ряд важных научно-исследовательских и производственных задач, не поддающихся решению классическими химическими методами.
Все ранее рассмотренные методы анализа основаны на протекании электродных реакций либо в отсутствие внешнего тока (потенциометрия), либо под током (вольтамперометрия, кулонометрия, электрогравиметрия). В отличие от них кондуктометрия является методом, в котором электродные электрохимические реакции либо не протекают, либо являются вспомогательными и не учитываются. В связи с этим в кондуктометрии важнейшее значение приобретает одно из свойств растворов электролитов - электропроводность.
В качестве аналитических сигналов в кондуктометрии могут быть использованы:
- изменение сопротивления электролита;
- изменение полного переходного сопротивления границы «электрод – электролит»;
- общее изменение сопротивления электролитической ячейки.
В зависимости от того, какой аналитический сигнал используется при проведении анализа, различают собственно кондуктометрию, низкочастотную кондуктометрию и высокочастотную кондуктометрию.
Кондуктометрический анализ обычно проводят при использовании переменного тока. Поэтому, прежде чем перейти к рассмотрению закономерностей кондуктометрии, остановимся на явлениях, которые возникают в электролитической ячейке при прохождении синусоидального переменного электрического тока; рассмотрим также электропроводность растворов электролитов.
2.6.1. Электропроводность растворов электролитов. Электропроводность растворов является результатом диссоциации растворенного вещества и миграции ионов под действием электрического поля.
Как и все проводники электрического тока, растворы электролитов характеризуются определенным сопротивлением. Величина, обратная сопротивлению раствора, называется электропроводностью среды:
 , (53)
, (53)
где
W - электропроводность раствора электролита, Ом-1;
R -сопротивление раствора электролита, Ом.
Известно, что сопротивление раствора электролита прямо пропорционально расстоянию lмежду погруженными в него электродами и обратно пропорционально их площади S:
 , (54)
, (54)
где ρ - удельное сопротивление.
Величина, обратная удельному сопротивлению, называется удельной электропроводностью:
 . (55)
. (55)
Удельная электропроводность - это электропроводность объема раствора, заключенного между параллельными электродами площадью 1 см2 каждый, находящимися на расстоянии 1 см друг от друга. Размерность удельной электропроводности выражается в Ом-1×см-1.
Электропроводность электролитов удобнее относить к числу эквивалентов растворенного вещества. Поэтому введено понятие эквивалентной электропроводности.
Эквивалентной электропроводностью называется электропроводность объема электролита, заключенного между параллельными электродами, расположенными на расстоянии 1 см друг от друга и имеющими такую площадь, чтобы между ними содержался 1 эквивалент вещества. Размерность эквивалентной электропроводности выражается в Ом-1см-1экв-1.
Удельная и эквивалентная электропроводности связаны между собой определенной зависимостью:
 , (56)
, (56)
где с - концентрация электролита, экв.
Наконец, различают электропроводность при бесконечно большом разведении λ∞ (иногда ее называют «предельная эквивалентная электропроводность»).
Электропроводность при бесконечном разведении может быть представлена как сумма двух слагаемых, зависящих от природы катиона и аниона, которые входят в состав вещества:
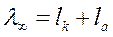 , (57)
, (57)
где lк - подвижность катиона;
l а - подвижность аниона.
Подвижности ионов представляют собой произведение абсолютной скорости движения ионов  на число Фарадея:
на число Фарадея:

 . (58)
. (58)
В бесконечно разбавленных растворах абсолютная скорость движения каждого иона есть величина постоянная (при t= const). Поскольку число Фарадея также является константой, то подвижность для каждого иона является постоянной величиной (табл.1).
Таблица 1
Подвижности ионов при бесконечном разведении в водных растворах,
Ом-1•cм-1•экв-1 (t =25 0С)
| Катион | lк | Анион | la |
| Н+ | 349,8 | ОН- | 198,3 |
| NH4+ | 73,6 | 1/2 C2042- | 110,5 |
| K+ | 73,5 | I- | 78,8 |
| 1/2 Ва2+ | 63,6 | Br- | 78,1 |
| Ag+ | 61,9 | Сl- | 76,4 |
| 1/2 Са2+ | 59,5 | NO3- | 71,5 |
| 1/2Cu2+ | 56,6 | СlO4- | 64,5 |
| 1/2 Fe2+ | 53,5 | F- | 55,4 |
| Na+ | 50,1 | СН3СОО- | 40,9 |
Растворы электролитов характеризуются степенью их диссоциации:
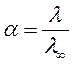 . (59)
. (59)
Чем сильнее диссоциирует электролит, тем лучше его электропроводность и, стало быть, меньше его сопротивление. Поскольку принимается, что сильные электролиты диссоциируют нацело (на самом деле это не так), то для них формула (59) записывается в виде:
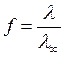 ,
,
где f - коэффициент электропроводности.
Зависимость электропроводности от концентрации. Электропроводность растворов электролитов зависит от их концентрации. При увеличении концентрации можно было бы ожидать, что удельная электропроводность будет возрастать, т.к. увеличивается число ионов, переносящих ток в растворе. Однако эта зависимость не соблюдается - при достижении определенного максимального значения удельная электропроводность начинает уменьшаться (рис.43).

Рис.43. Зависимость удельной электропроводности от концентрации водных растворов электролитов
Такой характер изменения электропроводности объясняется тем, что при дальнейшем росте концентрации уменьшаются расстояния между ионами, следовательно, понижаются скорости их движения вследствие усиления межзонного взаимодействия. Для сильных электролитов усиливаются релаксационный и электрофоретический эффекты торможения, а для слабых электролитов уменьшается их степень диссоциации. Эквивалентная электропроводность увеличивается с разбавлением (рис.44) и достигает максимального предельного значения при бесконечном разбавлении (с→0). С разбавлением ослабляются силы межзонного взаимодействия и увеличиваются скорости движения ионов. Кроме того, в растворах слабых электролитов по мере уменьшения концентрации растет степень диссоциации.
Зависимость электропроводности от природы электролита, и природы растворителя. Природа электролита оказывает заметное влияние на электропроводность, т.к. различные ионы движутся с разными скоростями. Так, аномально высокой подвижностью в водных растворах обладают ионы водорода и гидроксила (см. табл.1), что объясняется специфическим механизмом их движения в растворе электролита.

Рис.44. Зависимость эквивалентной электропроводности от концентрации водных растворов электролитов
Природа растворителя также оказывает влияние на удельную и эквивалентную электропроводности электролита. Основными свойствами растворителя, влияющими на электропроводность, являются его вязкость и диэлектрическая проницаемость. Это связано с изменением скорости движения ионов, степени диссоциации электролитов. Чем больше вязкость, тем меньше скорость движения ионов. В растворителях с низкими значениями диэлектрической проницаемости наблюдаются процессы ассоциации ионов. Поэтому чем меньше диэлектрическая проницаемость растворителя, тем ниже электропроводность электролитов.
Влияние температуры на электропроводность. Удельная и эквивалентная электропроводности электролитов повышаются с ростом температуры. Это объясняется увеличением скорости движения ионов в связи с понижением вязкости раствора и уменьшением гидратации ионов.
Повышение температуры на, один градус вызывает увеличение электропроводности раствора на 2-2,5%.
2.6.2. Явления на электродах электролитической ячейки при прохождении синусоидального тока. Ранее было показано, что при пропускании постоянного тока через электролитическую ячейку напряжение, приложенное к ее электродам, складывается из разности потенциалов поляризованных анода и катода и падения напряжения в электролите:  .
.
В случае прохождения через ячейку переменного синусоидального тока в уравнении (28) неизменным остается лишь падение напряжения в электролите iR. Слагаемые, связанные с электродными реакциями, претерпевают существенные изменения.
Как известно, при погружений электродов в раствор на межфазной границе «электрод-раствор электролита» возникает двойной электрический слой, представляющий собой реальный физический конденсатор. Его емкостное сопротивление переменному току рассчитывается по формуле:
 , (60)
, (60)
где
 - частота тока, Гц;
- частота тока, Гц;
С - емкость, Ф.
Если на клеммы электролитической ячейки подать необходимое напряжение переменного тока, то будет иметь место электролиз. Казалось бы, электрическую эквивалентную схему одного из электродов ячейки можно смоделировать в виде конденсатора с током утечки (рис.45).

Рис.45. Упрощенная эквивалентная схема границы «электрод-электролит»
Однако в действительности эквивалентная схема сопротивления границы «электрод-электролит» оказывается значительно сложнее, поскольку мы должны учитывать поляризационные явления на электродах ячейки. Так, в случае концентрационной поляризации при включении тока в приэлектродном слое через очень короткий промежуток времени концентрация разряжающихся ионов резко уменьшится из-за замедленности их доставки диффузией из глубины электролита к поверхности электрода. В результате ток будет уменьшаться, аэлектродный потенциал расти. Таким образом, между периодически меняющейся силой тока и электродным потенциалом создается сдвиг по фазе - изменение потенциала постоянно отстает во времени от изменения тока. Следовательно, концентрационная поляризация проявляет себя как реактивная составляющая, как емкость в схеме. Смоделировать концентрационную поляризацию можно введением в схему конденсатора СR и сопротивления RR. Однако в отличие от реального физического конденсатора, каковым является, например, емкость двойного электрического слоя, емкость конденсатора CR и сопротивление RR зависят от частоты переменного тока.
Аналогичным образом может быть учтена и химическая поляризация. В результате эквивалентную схему сопротивления границы «электрод-электролит» для одного из электродов ячейки можно смоделировать (рис.46), где Сдв.сл - емкость двойного электрического слоя, не зависящая от частоты переменного тока; Rреакции – активное сопротивление, моделирующее химическую поляризацию, также не зависящее от частоты переменного тока; СR и RR - емкостный и активный компоненты, моделирующие концентрационную поляризацию и зависящие от частоты переменного тока; Cадс - реактивный компонент, моделирующий адсорбционные явления на электродах и зависящий от частоты переменного тока; Rэ - сопротивление электролита, не входящее в полное сопротивление границы «электрод-электролит».
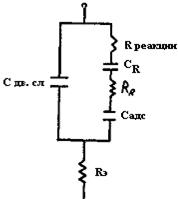
Рис.46. Полная эквивалентная схема сопротивления границы «электрод – электролит»
Полное переходное сопротивление границы «электрод-электролит», называемое импедансом (Zграниц), содержит не только активные сопротивления, но и реактивные, из которых емкость двойного электрического слоя Сдв.сл и Rреакции не зависит от частоты переменного тока, остальные элементы схемы являются частотнозависимыми. Аналогично будет выглядеть схема импеданса для другого электрода ячейки.
Таким образом, полное сопротивление электролитической ячейки (Zячейки), синусоидальному переменному току складывается из сопротивления раствора электролита (Rэ) и импеданса (Zграниц):
 . (61)
. (61)
Сопротивление электролита Rэ и импеданс Zграниц зависят от природы, состава раствора и частоты переменного тока совершенно по-разному. Следовательно, для методов физико-химического анализа возможно использовать либо измерение Rэ, либо Zграниц, либо, наконец, Zячейки.
Анализ уравнения (61) приводит к следующим результатам. Если в измерениях наличие емкостной составляющей мешает проведению анализа (например, при уравновешивании моста Кольрауша, что будет показано ниже), необходимо повысить частоту до 2000 - 4000 Гц. Но из уравнения (60) следует, что с резким повышением частоты переменного тока ω емкостное сопротивление двойного электрического слоя Rc станет весьма малым и зашунтирует правую половину схемы импеданса (см. рис.46). Следовательно, Zграниц, будет очень малым и на первый план выйдет сопротивление электролита RЭ по изменении которого можно проводить анализ. В результате мы имеем случай прямой кондуктометрии и кондуктометрического титрования.
В других случаях при проведении анализа мы можем оказаться заинтересованными в выделении импеданса, т.е. полного переходного сопротивления границы «электрод-электролит». Для увеличения Zграниц, в соответствии с формулой (60), необходимо снизить частоту переменного тока до 7-50 Гц. Сопротивление раствора можно резко уменьшить добавкой фона, например, крепкой серной кислоты. В результате мы будем иметь случай низкочастотной кондуктометрии.
Наконец, возможен и третий случай - высокочастотная кондуктометрия, основанная на измерении полного сопротивления ячейки (Zячейки) при частоте переменного синусоидального тока 1-ЗОмГц.
2.6.3. Прямая кондуктометрия, Кондуктометрическое титрование. Метод основан на измерении электропроводности (или сопротивления) анализируемого раствора при частоте переменного синусоидального тока 2000-4000 Гц.
2.6.3.1. Теоретические основы метода. Электропроводность зависит от многих факторов, а в частности, от природы вещества и концентрации ионов в растворе. При определенных условиях возможна прямая пропорциональность между этими величинами. Следовательно, измеряя электропроводность, можно количественно определять содержание различных веществ в исследуемом растворе.
Обычно строят график зависимости электропроводности от ряда стандартных растворов с известной концентрацией какого-либо вещества. Затем измеряют электропроводность раствора с неизвестной концентрацией и по графику находят концентрацию.
Следует отметить, что малейшие примеси значительно изменяют электропроводность электролита. Поэтому данный метод находит ограниченное применение в проведении исследовательских работ и в лабораторной практике, хотя в промышленных условиях его применяют довольно широко. Так, прямая кондуктометрия позволяет решать многие практические задачи, например, контролировать качество дистиллированной воды, оценивать загрязненность сточных вод, определять общее содержание солей в минеральной, морской и речной воде.
Кондуктометрическое титрование. Большое распространение в аналитической практике получил метод кондуктометрического титрования, основанный на использовании химической реакции, в результате которой происходит заметное изменение электропроводности раствора. После добавления каждой порции титранта измеряют электропроводность. Полученные данные используют для построения зависимости в координатах «электропроводность - объем добавленного титранта», Эти зависимости представляют собой кривые кондуктометрического титрования. По излому кривых в точке эквивалентности находят объем титранта, вступившего в реакцию.
При кондуктометрическом титровании могут быть использованы химические реакции всех типов: осаждения, комплексообразования, окислительно-восстановительные, кислотно-основного взаимодействия.
Рассмотрим, как изменяется электропроводность в процессе титрования раствора, ВаСl2 раствором Na2S04:
BaCl2 + Na2SO4 Þ BaSO4 + 2NaCl
Запишем реакцию осаждения ВаS04в ионной форме:
Ba2+ + 2Cl- +2Na+ + SO42- Þ BaSO4ß + 2Na+ + 2Cl-
В начальном растворе имеются ионы Вa2+ и Cl-, в титранте ионы Na+ и SO42-. По мере добавления титранта ионы Ва2+ связываются с ионами S042- в осадок. Содержание ионов Сl-в растворе остается неизменным. Подвижность ионов Ba2+ равна 63,6; Na+ - 50,1. Следовательно, добавлением титранта более подвижный ион Ва2+ заменяется менее подвижным ионом Na+- электропроводность раствора будет уменьшаться (рис.47,а).

Рис.47. Кривые кондуктометрического титрования
Уменьшение электропроводности будет происходить до тех пор, пока все ионы Ва2+ из раствора не перейдут в осадок. После этого дальнейшее добавление Na2S04 увеличит электропроводность раствора, так как в растворе появляются избыточные ионы Na+ и S042-. Излом кондуктометрической кривой соответствует эквивалентной точке титрования. Зная нормальность титранта и его эквивалентный объем, рассчитывают концентрацию ВaСl2 в исследуемом растворе.
 ,
,
откуда
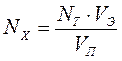 , (62)
, (62)
где
Nx - концентрация исследуемого раствора, экв/л;
Nт - нормальность титранта, экв/л;
Vэ - эквивалентный объем титранта, мл;
Vп - объем пробы исследуемого раствора, взятый для титрования, мл.
Подобного типа кондуктометрические кривые получаются во всех случаях, когда более подвижный ион заменяется при титровании на менее подвижный ион. Так, при нейтрализации сильных кислот сильными основаниями реакция идет согласно уравнению H+ + Cl- + Na+ + OH- Þ H2O + Na+ + Cl-.
По мере добавления титранта более подвижный ион Н+ (lн+=349,8) связывается с ионом ОН- в Н2О, а вместо него появляется малоподвижный ион Na+ (lNa+= 50,1). Уменьшение электропроводности будет продолжаться до тех пор, пока все ионы H+ исследуемого раствора не свяжутся в воду; дальнейшее добавление ОН+ резко увеличит электропроводность раствора (рис.47,б). Кривые титрования кислот средней силы изогнуты и могут давать пологий минимум, не имеющий аналитического значения. Например, кривая титрования монохлоруксусной кислоты (рК=2,75) имеет пологий минимум (рис.47, в).
Еще сложнее обстоит дело при титровании слабых кислот сильными основаниями. Так, формы кондуктометрических кривых при титровании уксусной кислоты сильным основанием зависят от концентрации кислоты (рис.48,а). При титровании 0,1 N раствора СН5СООН раствором NaOH в начале титрования наблюдается минимум электропроводности (рис.48,а, кривая 1).

Рис.48. Кривые кондуктометрического титрования
Однако диссоциация уксусной кислоты быстро подавляется, и на большей часта кондуктометрической кривой, до точки эквивалентности, происходит линейное повышение электропроводности, вызываемое накоплением ионов Nа+ и CH3COO-. По достижении точки эквивалентности дальнейшее добавление титранта вызывает резкое увеличение электропроводности за счет не связывающихся ионов ОН-. С разбавлением уксусной кислоты кривые титрования приобретают форму, характерную для более сильных кислот (см. рис. 48, а) (0,001N CH3COOН-кривая 2, 0,0001N СН3СООН - кривая 3).
Уменьшение электропроводности происходит потому, что образующиеся в растворе ионы СН3СООН- также подавляют диссоциацию СН3СООН. Однако в связи с увеличением степени диссоциации СН3СООН в разбавленных растворах не происходит полного подавления ее диссоциации. Равновесная концентрация водородных ионов в этих условиях остается достаточно высокой, и при их нейтрализации электропроводность понижается.
При титровании очень слабых кислот становится заметным влияние гидролиза образующихся солей, которое выражается в плавном изгибе кондуктометрической кривой вблизи точки эквивалентности (рис. 48, б).
Кондуктометрическое титрование может быть использовано при анализе смесей кислот. Возможность анализа этих смесей зависит от констант диссоциации кислот и их концентрации. Наиболее благоприятные условия создаются при титровании смесей сильных и слабых кислот, т.к. в этом случае сначала нейтрализуется сильная кислота, затем слабая. На рис.48,в представлена кривая кондуктометрического титрования смеси хлористоводородной и борной кислот. Вначале нейтрализуется сильная кислота, и электропроводность понижается до точки эквивалентности. Затем начинает оттитровываться слабая кислота - электропроводность незначительно возрастает до точки эквивалентности, а после нее резко идет вверх. Vэ' и Vэ" на этом графике - эквивалентные объемы титранта, пошедшие на нейтрализацию соответственно сильной и слабой кислот.
Дата добавления: 2015-07-21; просмотров: 147 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 4 страница | | | ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 6 страница |