
Читайте также:
|
а) Сократительные белки: актин, миозин;
б) регуляторные белки: тропомиозин, тропонин.
Сокращение – один из характерных признаков живого. Сокращение
живой протоплазмы – основа многообразных движений. Функция мышц обусловлена рядом биохимических процессов, при которых в мышечных волокнах химическая энергия трансформируется в энергию, совершаемую мышцей при сокращении. Всю мускулатуру животного организма можно подразделить на две группы: поперечно-полосатые или скелетные мышцы, обеспечивающие все произвольные движения, выполнение физической работы, и гладкие – непроизвольные движения внутренних органов.
Структурная единица мышцы – мышечное волокно (его длина до 10-12 см., диаметр 0,1-0,02 мм).
Оболочка мышечного волокна построена из эластичных нитей – белков стромы, позволяющей клетке сокращаться и растягиваться. Сократительными элементами мышечной ткани являются миофибриллы, расположенные в форме пучков в цитоплазме мышечного волокна. Под микроскопом видна поперечная исчерченность из-за оптической неоднородности входящих в их состав белков.
Скелетные мышцы теплокровных животных содержат 74-78% Н2О и 26-22% сухого вещества. Основная масса сухого вещества приходится на долю белков 18-20%. Липиды составляют 1-3%, соли 1,5-2%, углеводы 0,5-3%. Содержание белковых мышц достигает 20,9%.
На основании растворимости белки можно разделить на фракции (содержание в % к общему белку мышц):
миогеновая фракция - 28%
группа глобулина Ŷ - 20%
группа миозина - 30-50%
группа актина - 10-12%
группа стромы - 9,5%
тропомизин - 2,5%
миоглобин - 0,2-0,6%
Миогеновая фракция: легко извлекается из мышц водой, представляет собой белки типа альбуминов. Ряд белков этой фракции обладает ферментативной активностью, катализируют процессы анаэробного и аэробного распада углеводов. Это – альдолаза, изомераза.
Глобулин Ŷ – также обладает ферментативной активностью.
Миозин представляет собой две полипептидные цепи, свернутые в двойную спираль. Конец (головка) молекулы миозина имеет глобулярное строение и связан нековалентно с четырьмя дополнительными короткими полипептидными цепями. При обработке трипсином миозин распадается на 2 фракции: легкий меромиозин и тяжелый меромиозин Н.
Миозин – высокомолекулярный белок (более 440 000). Имеет участки,
обладающие АТФ-азной активностью, проявляющейся в присутствии Са2+
.
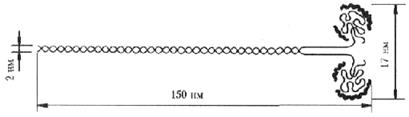
Структура миозина
Легкий мирозин отличается от тяжелого по аминокислотному составу свойствами. Тяжелый миозин обладает ферментативной активностью. Он является аденозинтрифосфотазой и гидролитически расщепляет АТФ. Это можно описать: АТФ + H2O → АДФ + H3PO4 + W (энергия).
Актин – белок с более низкой молекулярной массой (42000). Может быть в двух формах: глобулярной (G) или фибриллярной (F). После прибавления солей G-актин легко переходит в F-актин. F-актин является полимером G-актина. Этот переход осуществляется под влиянием ионов К+: актин глобулярный → актин фибрилярный F. Актин F легко соединяется с миозином и образует новый белок-актомиозин.
F-актин состоит из двух филаментов скрученных в спираль.
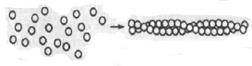 |
Структура актина
Для актомиозина характерны следующие свойства:
1. способность разлагать АТФ;
2. освобождать энергию макроэргических связей;
3. превращать эту энергию в работу.
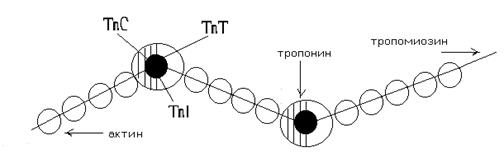
Тропомиозин – состоит из двух полипептидных цепей образующих двойную спираль, располагается в бороздке на поверхности – F актина по длине соответствует 7 субъектам - G-актина. Комплекс тропонина состоит из трех субъединиц с глобулярной структурой и расположен примерно на концах Тm. Tропонин Т (TnT) обеспечивает связь с Тm. Tропонин С (TnC) образует связь с ионами Са2+ на поверхности Тm, в результате чего изменяется его конформация.
Тропонин I (TnI) может предотвращать взаимодействие актина с миозином. Положение ТnI переменно и зависит от концентрации Са2+. В присутствии Са2+ изменяется конформация ТnC. Это приводит к изменению положения TnI по отношению к актину, в результате он может взаимодействовать с миозином.
 |
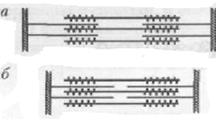 |
Состояние миофибриллы: а) покой; б) сокращение
Миоглобин – сложный белок хромопротеин, по строению близок к гемоглобину, находится в красных мышцах, способен связывать и отдавать кислород, способствуя снабжению мышечных волокон кислородом.
В состав белков протоплазмы входят ферменты гликолиза с высокой ферментативной активностью. Ферменты биологического окисления сосредоточены в митохондриях, где осуществляется окислительное фосфорилирование. В рибосомах, лизосомах содержатся ферменты, осуществляющие превращение белков и липидов.
Оксимиоглобин отдает кислород только при значительном снижении парциального давления. Миоглобин извлекается из тканей аммиачным раствором. Соединительнотканные белки входят в состав оболочек клетки и субклеточных образований, стенок сосудов, нервов. Их содержание составляет до 20% от общего количества мышц. Это главным образом коллаген; они не извлекаются даже растворами солей.
В мышце имеются аминокислоты, полипептиды, а также азотосодержащие вещества, которые легко извлекаются водой. Их называют экстрактивными веществами. К ним относятся креатин и креатинфосфат, на долю которых приходится до 60% всего небелкового азота. В покое весь креатин мышц представлен в виде креатинфосфата. Его концентрация в мышце довольно высокая (0,2-0,55%), в связи с тем, что он играет важную роль в передаче макроэргических связей внутри клетки, и обеспечивает ресинтез АТФ.
Креатинфосфат (КрФ) - макроэргическое соединение, способное отдавать фосфорную группу на АДФ; реакцию катализирует креатинфосфаткиназа по схеме:
АДФ + Крф → креатинфосфаткиназа АТФ – Кр (креатин)

Креатин синтезируется в почках из аргинина.
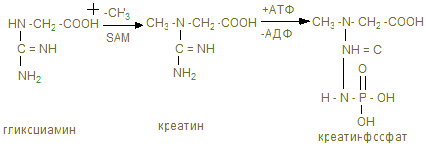
В мышцы креатин доставляется с кровью.
Креатинфосфат (Крф) резерв макроэргических связей в мышце.
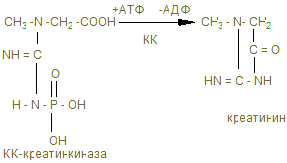
В мышцах можно обнаружить и некоторое количество креатинина, образующегося при разрушении Крф (креатинфосфата).
К числу азотосодержащих экстрактивных веществ относится ансерин, карнитин, карнозин (β-аланин-гистидин). В мышцах высоко содержание адениловых нуклеотидов, которые относятся к экстрактивным веществам (до 0,4 %) АТФ, АМФ, АДФ.
Углеводы представлены в основном гликогеном (0,5-0,8%). Основная масса гликогена организма сосредоточена в мышцах, хотя в печени его концентрация выше (5%). Моносахариды представлены преимущественно в виде гексозофосфатов, их концентрация не превышает концентрацию глюкозы в крови.
Минеральные вещества – (зола) составляет 1-1,5% массы мышц. Наряду с К+ и Na+ в мышцах содержится Ca2+ и Мg2+, которые играют важную роль в механизме мышечного сокращения. В условиях покоя Са2+ сосредоточен преимущественно в трубочках и пузырьках саркоплазматического ретикулума.
Основная масса фосфора (около 80%) мышечной ткани входит в состав макроэргических соединений (АТФ и креатинфосфат), 10% представлено в виде солей неорганического фосфата, 5% связано с гексозами и 5% входит в состав АДФ, АМФ и других нуклеотидов.
Химический состав гладких мышц включает те же вещества, что и поперечно-полосатые мышцы, но в других количественных соотношениях. В них меньше актомиозина и миозина, но больше миоальбумина и нерастворимых белков стромы (коллагена). Содержание гликогена менее 0,5%, меньше и экстрактивных веществ. Содержание Са2+ в гладких мышцах ниже.
Дата добавления: 2015-07-20; просмотров: 74 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Особенности строения мышечного волокна | | | Химизм мышечного сокращения |