
|
Читайте также: |
ПО АТОМНОЙ ЭНЕРГИИ «РОСАТОМ»
ФГОУ СПО «Южно-Уральский политехнический колледж»
Курсовая работа
по дисциплине: «Технология неорганических веществ»
Тема: «Двойной суперфосфат»
Выполнил:
студентка
гр. ХТ – 72 Н.И.Байрамова
Проверил: В.Н. Десятник
г. Озерск
Содержание
| 1. | Введение | |
| 2. | Открытие фосфора | |
| 3. | Фосфор в природе | |
| 4. | Фосфорные удобрения | |
| 5. | Двойной суперфосфат | |
| 6. | Химизм процесса | |
| 7. | Способы и параметры производства | |
| 8. | Технологические расчеты | |
| 9. | Список литературы |
1.Введение
Суперфосфат – смесь Ca(H2PO4)2*H2O и CaSO4. Это наиболее распространённое минеральное фосфорное удобрение. Фосфор в суперфосфате присутствует в основном в виде монокальцийфосфата и свободной фосфорной кислоты. Удобрение содержит гипс и др. примеси (фосфаты железа и алюминия, кремнезём, соединения фтора и др.). Получают суперфосфат из природных фосфатов (апатита и фосфорита) или апатитового концентрата, обрабатывая их серной кислотой, по реакции:
Са3(РО4)2 + 2H2SO4 = Сa(H2PO4)2 + 2CaSO4.
Для получения двойного суперфосфат апатит или фосфорит обрабатывают фосфорной кислотой.
Производят несколько видов суперфосфатов. Простой суперфосфат – серый порошок, почти не слёживаемый, среднерассеваемый; в удобрении 14-19,5% усвояемой растениями P2O5. Его получают действием H2SO4 на природные фосфаты (апатиты, фосфориты). Гранулированный суперфосфат получают из простого (порошковидного), увлажняя его и окатывая в гранулы (диаметр их в основном 2-4 мм) во вращающихся барабанах. Имеет повышенную рассеваемость. Обогащенный суперфосфат получают при разложении фосфатного сырья смесью H2SO4 и Н3РО4; по составу это продукт промежуточный между простым и двойным суперфосфатами и содержит 24-32% усвояемого Р2О5. Двойной суперфосфат производят действием Н3РО4 на природные фосфаты. Он содержит 45-48% усвояемой растениями P2O5, очень мало гипса, выпускается преимущественно гранулированным. В состав аммонизированного суперфосфата, кроме 14-19,5% Р2О5 входит не менее 1,6% аммиака; марганизированного суперфосфата – 1,5-2,5% марганца; борного суперфосфата – 0,1-0,3% бора; молибденового суперфосфата – 0,1% молибдена.
Суперфосфат применяют на всех почвах в качестве основного предпосевного, припосевного (лучше гранулированный суперфосфат) удобрения и в подкормки. Особенно эффективен на щелочных и нейтральных почвах. В кислой почве фосфорная кислота удобрения превращается в труднодоступные растениям фосфаты алюминия и железа. В этом случае действие суперфосфата повышается при смешивании его перед внесением с фосфоритной мукой, известняком, мелом, перегноем при применении на известкованных полях. Суперфосфат ускоряет рост и цветение растений, способствует быстрому созреванию плодов и развитию корневой системы. Хранится в закрытых складских помещениях, исключающих попадание осадков и грунтовых вод.
2.Открытие фосфора.
История открытия химических элементов полна личных драм, различных неожиданностей, таинственных загадок и удивительных легенд. Успех оказывался верным спутником тех, кто умел пристально всматриваться в природные явления.
Древние фолианты сохранили для нас отдельные эпизоды из жизни отставного солдата и гамбургского купца. Звали его Хенниг Бранд (1630-?). Его купеческие дела шли не блестяще, и именно по этой причине он стремился выбраться из нищеты. Она его ужасно угнетала. И Бранд решил попытать счастья в алхимии. Тем более что в XVII веке считалось вполне возможным найти «философский камень», который способен превращать неблагородные металлы в золото.
Бранд провел уже множество опытов с различными веществами, но ничего дельного у него не получалось. Однажды он решил провести химический эксперимент с мочой. Выпарил ее почти досуха и оставшийся светло-желтый осадок смешал с углем и песком, нагревая в реторте без доступа воздуха. В результате Бранд получил новое вещество, которое обладало удивительным свойством – светиться в темноте.
Так в 1669 г. был открыт фосфор, играющий исключительно важную роль в живой природе: в растительном мире, в организме животных и человека.
Счастливый ученый не замедлил воспользоваться необычным свойством нового вещества и стал демонстрировать светящийся фосфор знатным особам за довольно высокое вознаграждение. Все, что соприкасалось с фосфором, приобретало способность светиться. Достаточно было помазать фосфором пальцы, волосы или предметы, и они вспыхивали таинственным голубовато-белым светом. Религиозно и мистически настроенные богатые люди того времени диву давались, смотря на различные манипуляции Бранда с этим «божественным» веществом. Он ловко использовал огромный интерес ученых и широкой публики к фосфору и стал продавать его по цене, превосходившей даже стоимость золота. X. Бранд производил фосфор в больших количествах и держал способ его получения в строжайшей тайне. Никто из других алхимиков не мог проникнуть в его лабораторию, и поэтому многие из них стали лихорадочно ставить различные опыты, стремясь раскрыть секрет изготовления фосфора.
В 1680г. секрет получения фосфора был открыт в Англии знаменитым химиком Р. Бойлем. После смерти Р. Бойля его ученик немец А. Ганквиц, улучшив методику получения фосфора, наладил его производство и даже попытался изготовить первые спички. Он снабжал фосфором научные учреждения Европы и отдельных лиц, желающих приобрести его. Для расширения торговых связей А. Ганквиц посетил Голландию, Францию, Италию и Германию, заключая новые договора на продажу фосфора. В Лондоне им была основана фармацевтическая фирма, получившая широкую известность.
Лишь столетие спустя после обнаружения фосфора он перешел из мира торговли и наживы в мир науки.
3.Фосфор в природе
Фосфор по своей важности ничуть не уступает азоту. Он участвует в великом природном круговороте веществ, и, не будь фосфора, растительный и животный мир был бы совсем иным. Однако фосфор встречается в природных условиях не так уж часто, в основном в виде минералов, и на его долю приходится 0,08% массы земной коры. По распространенности он занимает тринадцатое место среди других элементов. Интересно отметить, что в теле человека на долю фосфора приходится примерно 1,16%. Из них 0,75% уходит на костную ткань, около 0,25% – на мышечную и примерно 0,15% – на нервную ткань.
Фосфор редко встречается в больших количествах, и в целом его следует отнести к рассеянным элементам. В свободном виде в природе он не обнаружен, так как обладает очень важным свойством – легко окисляется, но содержится во многих минералах, число которых уже составляет 190. Главнейшие из них - фторапатит, гидроксилапатит, фосфорит. Несколько реже встречаются вивианит, монацит, амблигонит, трифилит и совсем в ограниченных количествах - ксенотит и торбернит.
Что касается минералов фосфора, то они делятся на первичные и вторичные. Среди первичных наиболее распространены апатиты, представляющие в основном породы магматического происхождения. Химический состав апатита - фосфат кальция, содержащий некоторое количество фторида и хлорида кальция. Кроме того, они содержат от 5 до 36% Р2О5. Обычно эти минералы в большинстве случаев встречаются в зоне магмы, но нередко они обнаруживаются в местах, где изверженные породы соприкасаются с осадочными. Из всех известных месторождений фосфатов наиболее значительные имеются в Норвегии и Бразилии. Крупное отечественное месторождение апатитов открыто академиком А. Е. Ферсманом в Хибинах в 1925 г. «Апатит в основном соединение фосфорной кислоты и кальция, – писал А. Е. Ферсман. –Внешний вид этого минерала так разнообразен и странен, что старые минералоги назвали его апатитом, что значит по-гречески «обманщик». То это прозрачные кристаллики, до мелочей напоминающие берилл или даже кварц, то это плотные массы, неотличимые от простого известняка, то это радиально-лучистые шары, то порода зернистая и блестящая, как крупнозернистый мрамор».
Апатиты в результате действия процессов выветривания, жизнедеятельности бактерий, разрушения различными почвенными кислотами переходят в формы, легко потребляемые растениями, и таким образом вовлекаются в биохимический круговорот. Следует отметить, что фосфор усваивается только из растворенных солей фосфорной кислоты. Однако фосфор из почвы частично вымывается, а большое количество его, поглощенное растениями, не возвращается обратно в почву и уносится вместе с урожаем. Все это приводит к постепенному истощению почвы. При внесении в почву фосфорных удобрений урожайность увеличивается.
Несмотря на значительные потребности в фосфорных удобрениях, особых опасений, связанных с истощением запасов сырья, для их производства, по всей видимости, нет. Эти удобрения могут быть получены при комплексной переработке минерального сырья, донных морских отложений и различных геологических пород, богатых фосфором.
При разложении богатых фосфором соединений органического происхождения нередко образуются газообразные и жидкие вещества. Иногда можно наблюдать выделение газа с запахом гнилой рыбы – фосфористого водорода, или фосфина, РН3. Одновременно с фосфином идет образование другого продукта – дифосфина, Р2Н4, представляющего собой жидкость. Пары дифосфина самовоспламеняются и поджигают газообразный фосфин.
Фосфин и дифосфин в природе встречаются довольно редко, и чаще приходится иметь дело с такими соединениями фосфора, как фосфориты. Это вторичные минералы-фосфаты органического происхождения, играют особо важную роль в сельском хозяйстве. На островах Тихого океана, в Чили и Перу они образовались на основе птичьего помета – гуано, который в условиях сухого климата накапливается мощными слоями, нередко превышающими сотню метров.
Образование фосфоритов может быть связано и с геологическими катастрофами, например с ледниковым периодом, когда гибель животных носила массовый характер. Подобные процессы возможны и в океане при массовой гибели морской фауны. Быстрое изменение гидрологических условий, которое может быть связано с различными процессами горообразования, в частности с действием подводных вулканов, несомненно, в отдельных случаях приводит к смерти морских животных. Фосфор из органических остатков частично усваивается растениями, но в основном, растворяясь в морской воде, переходит в минеральные формы. Морская вода содержит фосфаты в довольно больших количествах – 100-200 мг/м3. При определенных химических процессах в морской воде фосфаты могут выпадать в осадок и скапливаться на дне. А при поднятии морского дна в различные геологические периоды залежи фосфоритов оказываются на суше. Подобным образом могло образоваться крупное отечественное месторождение фосфоритов вблизи Кара-Тау в Казахстане. Встречаются фосфориты и в Подмосковье.

Рис. 1 Круговорот фосфора в природе
4.Фосфорные удобрения
Фосфорные удобрения, содержат в качестве основного питательного элемента фосфор. Различают следующие виды фосфорных удобрений:
Ø водорастворимые – аммофос, диаммофос, суперфосфаты;
Ø цитраторастворимые – растворимые в щелочном растворе цитрата аммония (преципитат и др.);
Ø лимоннорастворимые - растворимые в 2%-ном водном растворе лимонной кислоты (обесфторенные фосфаты, плавленый магниевыйфосфат
, термофосфаты, фосфатные сталеплавильные шлаки и др.);Ø труднорастворимые - очень плохо растворимые в слабых кислотах, не растворимые в воде (фосфоритная мука, костная мука).
Степень растворимости фосфорных удобрений определяет желательные размеры их частиц. Водорастворимые удобрения используют в основном в виде гранул (1-4 мм), цитрато- и лимоннорастворимые - обычно в виде порошков, труднорастворимые - только в виде тонкодисперсных порошков.
Основное сырье для производства большинства фосфорных удобрений – природные фосфаты. Способы их переработки: кислотное разложение (H2SO4 или H3PO4 - суперфосфаты); электровозгонка и последующее окисление фосфора с образованием термической H3PO4 (двойной суперфосфат); гидротермическое разложение с удалением фтора и переводом фосфора в цитрато- и лимоннорастворимые формы (обесфторенные фосфаты); спекание или сплавление с соединениями щелочных и щелочно-земельных металлов (термофосфаты); дробление, сушка и тонкое измельчение (фосфоритная мука).
Среди всех видов фосфорных удобрений наиболее универсальны водорастворимые удобрения, которые применяют на любых почвах под все сельско-хозяйственные культуры при допосевном (основном), припосевном (напр., в рядки) и послепосевном (для подкормки) способах внесения. Цитрато- и лимоннорастворимые удобрения также используют на любых почвах под все культуры, но преимущественно для основного внесения под вспашку. Этим же способом вносят в кислые почвы в более высоких дозах труднорастворимые удобрения.
Главная продукция промышленности фосфорных удобрений – водорастворимые удобрения (90% от общей выработки).
5. Двойной суперфосфат
Двойной суперфосфат – концентрированное водорастворимое удобрение, получаемое разложением молодого природного фосфата фосфорной кислотой. По внешнему виду это гранулированный продукт серого цвета различных оттенков – от светло-серого, почти белого, до темно-серого, – содержащий некоторое количество жидкой фазы.
Основным компонентом двойного суперфосфата является моногидрат монокальцийфосфата Са(Н2РО4)2*Н2О. Монокальцийфосфат – самое концентрированное водорастворимое бесхлорное фосфорно-калийное удобрение с общим содержанием питательных элементов 86%. Высокое содержание фосфора и калия обеспечивает его эффективное использование на почвах с низким уровнем плодородия.
Состав монокальцийфосфата
| 1. | Массовая доля усвояемых фосфатов в пересчете на Р2О5, %, не менее | |
| 2. | Массовая доля калия в пересчета на K2O, %, не менее | |
| 3. | Массовая доля нерастворимого в воде остатка в пересчете на сухое вещество, % | 0,1 |
| 4. | Массовая доля воды, %, не более | 0,5 |
| 5. | Массовая доля хлора, % | 0,003 |
Двойной суперфосфат отличается небольшим содержанием других компонентов, образующихся из примесей фосфорной кислоты и природных фосфатов (сульфат кальция, фосфаты железа и алюминия, мономагний-фосфат, кремнефториды, а также непрореагировавший фосфат, дикальцийфосфат, свободная фосфорная кислота и свободная влага).
6. Химизм процесса
При разложении фосфатов фосфорной кислотой происходят следующие основные реакции:
Ca5(PO4)3F + 7Н3РO4 + 5Н2O = 5Са(Н2РО4)2*Н2О + НF
CaCO3 + 2H3PO4 = Ca(H2PO4)2*H2O + CO2
(Ca, Mg)CO3 + 4H3PO4 = Са(Н2РО4)2*Н2О + Mg(Н2РО4)2*Н2О 2CO2
Оксиды железа и алюминия образуют средние фосфаты:
(Al, Fe)2O3 + 2H3PO4 + H2O = 2(Al, Fe)PO4*2H2O
Средние фосфаты алюминия и железа обладают отрицательным температурным коэффициентом растворимости: с повышением температуры ускоряется их кристаллизация. Аморфный АlРО4*2H2О медленно превращается в комплексные соли СаАlН(Р04)2*6Н2O, СаАl6H4(PO4)8*2H2O и СаАl6Н4(РО4)8*2Н2О. Аморфный фосфат FеРO4*H2O образуется только при избытке Fе2О3 в жидкой фазе. Чаще всего при достижении рН 2 реакция идет с образованием СаFе2Н4(РО4)4*5Н2O.
Выделяющийся НF взаимодействует с диоксидом кремния с образованием Н2SiF6 и SiF4:
4HF + SiO2 = SiF4 + 2H2O
SiF4 + 2HF = H2SiF6
Кремнефтористоводородная кислота превращается в кремнефториды кальция, натрия и калия, а тетрафторид кремния частично выделяется в газообразном состоянии. Причем степень его выделения возрастает с повышением температуры и концентрации P2О5 в жидкой фазе.
Протекание основных реакций сопровождается возрастанием температуры, а следовательно, и парциального давления паров SiF4. В процессе сушки при температуре более 70°С кремнефторид кальция разлагается по реакции:
СаSiF6(тв) + 2Н+(ж) → Н2SiF6(ж) + Са2+(ж) → SiF4(газ) + СаF2(тв) + 2Н+(ж)
Ион алюминия, попадающий в раствор в результате разложения побочных минералов фосфатных руд (нефелина, глауконита и глин), взаимодействует с ионами F- и SiF62- с образованием более прочных комплексов [АlF]2+, чем аналогичные соединения кремния. Образование их задерживает выделение фтористых соединений в газовую фазу.
Норма фосфорной кислоты
Стехиометрическую норму НзРО4 (n)на 100 массовых частей фосфорита подсчитывают по формуле:

где
 ,
,  ,
,  ,
, 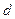 и
и  – содержание в фосфате соответственно СаО, МgО, Fе2О3, Аl2О3 и Р2О5, %;
– содержание в фосфате соответственно СаО, МgО, Fе2О3, Аl2О3 и Р2О5, %;
 ;
;  ;
;  ;
;  ;
;  – масса 1 моль соответствующих компонентов;
– масса 1 моль соответствующих компонентов;
 – концентрация ионов водорода в фосфорной кислоте.
– концентрация ионов водорода в фосфорной кислоте.
При разложении апатитового концентрата норму фосфорной кислоты подсчитывают по формуле:

где
 – принимаемая доля от стехиометрической нормы;
– принимаемая доля от стехиометрической нормы;
 – содержание Р2О5 в апатитовом концентрате, %;
– содержание Р2О5 в апатитовом концентрате, %;
 – содержание в фосфорной кислоте свободной Р2О5, %;
– содержание в фосфорной кислоте свободной Р2О5, %;
 – потребность Р2О5 кислоты, масс. ч. на 1 масс. ч. Р5О5 в апатите.
– потребность Р2О5 кислоты, масс. ч. на 1 масс. ч. Р5О5 в апатите.
Добавление к фосфорной кислоте таких сильных кислот, как азотная, соляная, кремнефтористоводородная и серная, либо их смесей ускоряет фосфорнокислотное разложение фосфатов. При разложении фосфата смесью кислот следует определить суммарную норму кислот в пересчете на 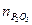 или
или  . Разница между суммарной нормой, не превышающей стехиометрическую (в пересчете на фосфорную кислоту), и нормой фосфорной кислоты составляет долю серной кислоты, выраженную в
. Разница между суммарной нормой, не превышающей стехиометрическую (в пересчете на фосфорную кислоту), и нормой фосфорной кислоты составляет долю серной кислоты, выраженную в 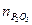 или
или  . Для пересчета на норму серной кислоты необходимо учитывать, что на разложение 1 моль апатита расходуется 7 моль фосфорной кислоты, а серной кислоты в два раза меньше:
. Для пересчета на норму серной кислоты необходимо учитывать, что на разложение 1 моль апатита расходуется 7 моль фосфорной кислоты, а серной кислоты в два раза меньше:
2Са5(РО4)3F + 7Н2SО4 + 6,5Н2О = 3Ca(H2PO4)2*H2O + 7CaSO4*0,5H2O + HF
При очень большом избытке фосфорной кислоты (400-500%) можно практически нацело разложить фторапатит. Обычно берут 105-110% кислоты от стехиометрического ее количества. Увеличение нормы фосфорной кислоты сверх оптимальной незначительно повышает степень разложения фосфата, но значительно ухудшает физические свойства двойного суперфосфата и увеличивает содержание в нем свободной кислотности.
Условия равновесия и кристаллизация твердых фаз
Знание этих условий весьма важно для правильного выбора технологического режима.
Процесс разложения фосфатов фосфорной кислотой состоит из двух стадий – растворения фосфата в растворах фосфорной кислоты, вначале ненасыщенных, а затем насыщенных фосфатами кальция. Эти стадии различаются по своим равновесным, а также кинетическим условиям.
Наибольшее разложение апатита в равновесных условиях достигается при более низких температурах и концентрациях фосфорной кислоты. Степень разложения фосфата в момент насыщения жидкой фазы составляет 5-7%.
Дальнейшее разложение фосфата во II стадии происходит при взаимодействии его с насыщенным раствором и сопровождается выделением твердой фазы. Данные о равновесии в системе могут быть использованы для выбора условий кристаллизации твердой фазы того или иного состава. При образовании в I стадии насыщенных эвтонических
растворов, дальнейшее разложение сопряжено с выделением в твердую фазу вначале смеси моно- и дикальцийфосфата, а к концу процесса – одного дикальцийфосфата.
Кинетика разложенияфосфатов
В производстве двойного суперфосфата растворение природного фосфата в Н3РО4 (5-10 мин) сопровождается образованием частично нейтрализованного раствора фосфорной кислоты (I стадия), а затем, после его насыщения, в течение длительного времени – образованием также твердой фазы (II стадия).
Оптимальный режим разложения фосфата может быть установлен с учетом равновесных и кинетических условий на каждой стадии процесса.
Разложение фосфата фосфорной кислотой
Скорость разложения фосфата фосфорной кислотой (без кристаллизации твердой фазы) с образованием гомогенного раствора определяется законами диффузионных процессов. По мере нейтрализации свободной кислоты и ионов кальция вплоть до образования насыщенного раствора скорость процесса уменьшается.
При значительном избытке кислоты по отношению к реагирующему фосфату и абсолютно малой степени нейтрализации кислоты скорость разложения фосфата достаточно велика даже при использовании кислоты относительно небольшой концентрации.
Наибольшая скорость растворения апатита достигается при следующих концентрациях растворов, равновесных с
Са(Н2РО4)2*Н2О:
| Температура, °С | |||
| Концентрация Р2О5, % | 48,3 | 45,9 | 47,0 |
По мере приближения состава жидкой фазы к составу насыщенного раствора существенное значение приобретает концентрация водородных ионов среды. Скорость разложения фосфорита в насыщенных СаНРО4 растворах очень мала вследствие низкой активности водородных ионов в этих условиях. В растворах, насыщенных Са(Н2РО4)2, активность ионов Н+ резко возрастает, повышается и скорость разложения.
С повышением температуры увеличивается скорость взаимодействия водородных ионов с апатитом. Одновременно снижается концентрация ионов водорода в растворе. Суммарное действие двух противоположных эффектов, вызываемых повышением температуры, приводит к практической независимости скорости разложения апатита в тройной системе СаО – Р2О5 – Н2О от температуры.
Разложение фосфатов с кристаллизацией продукта реакции представляет собой II стадию процесса, протекающую после насыщения жидкой фазы системы растворимыми фосфатами кальция.
С увеличением концентрации и понижением температуры раствора степень разложения апатита к моменту завершения I стадии уменьшается. Соответственно увеличивается минимальное количество фосфорной кислоты, необходимое для полного его разложения без кристаллизации продукта реакции.
Разложение фосфатов с образованием загустевающей пульпы
При уменьшении нормы кислоты до стехиометрической и увеличении концентрации до 50% разложение фосфата в I стадии завершается в течение 5-10 мин. Далее происходит кристаллизация новой твердой фазы. По мере израсходования кислоты количество жидкой фазы уменьшается, а количество твердой увеличивается. При этом пульпа постепенно густеет, и наконец полностью схватывается. Кристаллизация твердой фазы и схватывание пульпы происходят тем быстрее, чем выше концентрация исходной фосфорной кислоты.
Суммарное влияние условий протекания процесса в I стадии и в период образования корки на зернах непрореагировавшего фосфата определяет скорость разложения в загустевающей пульпе.
Изменение степени разложения фосфата во времени в загустевающей пульпе определяется совместным влиянием активности ионов водорода раствора и свойств кристаллизующейся твердой фазы.
С увеличением концентрации кислоты от 13,6 до 53,6% разложение апатитового концентрата стехиометрической нормой фосфорной кислоты при 20°С ускоряется. Дальнейшее повышение концентрации кислоты приводит к замедлению этого процесса. Причем в течение первых 10-20 мин степень разложения мало зависит от нормы кислоты.
Увеличение нормы кислоты позволяет несколько увеличить скорость процесса в течение более длительного промежутка времени, однако рост степени разложения фосфата непропорционален повышению нормы кислоты вследствие неполного ее использования. С увеличением нормы кислоты возрастает содержание свободной кислотности в суперфосфате, что потребует в дальнейшем ее нейтрализации для улучшения качества готового продукта.
При низкой норме расхода кислоты качество двойного суперфосфата ухудшается из-за низкой степени разложения фосфата. Увеличение нормы кислоты сверх 110% стехиометрической не дает заметного улучшения качества продукта, но может привести к тому, что суперфосфат в камере не будет схватываться и вытечет из нее.
Степень разложения фосфата значительно возрастает с повышением температуры от 20 до 40°С. Дальнейшее повышение температуры до 70-80°С приводит к незначительному увеличению степени разложения. Это объясняется тем, что при температурах выше 40°С уже через очень короткий промежуток времени от начала реакции выделяется значительное количество кристаллов монокальцийфосфата, создающих сопротивление диффузии кислоты, в результате чего скорость процесса при температурах выше 40°С определяется диффузионным сопротивлением твердой корки продукта реакции, которое мало или совсем не зависит от температуры.
При температуре ниже 40°С степень разложения апатита заметно снижается, поэтому работа на холодной кислоте приводит к нарушениям технологического режима.
Выделение фтористых соединений в производстве двойного суперфосфата
При кислотной переработке природных фосфатов в газовую фазу выделяются НF и SiF4. В зависимости от способа производства, вида применяемых фосфатов и качества фосфорной кислоты доля фтористых соединений, выделяющихся в газовую фазу, колеблется от 10 до 55% массы фтора, поступающего с сырьем. Это значит, что на каждую тонну двойного суперфосфата можно получить от 5 до 20 кг кремнефтористоводородной кислоты с различным содержанием примесей.
Фтористый водород, образующийся при разложении фторапатита, реагирует с кремниевым ангидридом и силикатами:
6НF + Н2SiОЗ = Н2SiF6 + 3H2O
Аналогично взаимодействуют с НF цеолиты, содержащиеся в фосфоритах, а также аморфные кремниевые кислоты.
По мере протекания основных реакций увеличивается температура пульпы, а следовательно, и парциальное давление паров SiF4,образующегося по реакции:
2Н2SiF6 + Н2SiО3 ↔ 3SiF4 + 3Н2О
Ионы F- и [SiF6]2- взаимодействуют с ионом алюминия, образуя прочные комплексные фториды:
[SiF6]2- + Аl3+ +3Н2О = [AlF6]3- + Н2SiО3 + 4Н+
Возможно образование и других катионных комплексов: [AlF2]+ и [AlF]2+, а также трехфтористого алюминия АlFз. Ионы железа также образуют комплексные соединения с нонами фтора: [FeF4]- и [FeF6]3-.
При определенных условиях протекают следующие обратимые реакции:
Н2SiF6 + Ca(Н2PО4)2 ↔ CaSiF6 + 2Н3PО4
Н2SiF6 + 2NaН2PО4 ↔ Na2SiF6 + 2Н3PО4
Н2SiF6 + 2KН2PО4 ↔ K2SiF6 + 2Н3PО4
Н2SiF6 + 3Ca(Н2PО4)2 + 3H2O ↔ 3CaF2 + H2SiO3 + 6Н3PО4
При высоких концентрациях свободной Н3РО4 и при температурах 100-110°C равновесия этих реакций смещены влево. При низких концентрациях свободной Н3РО4 и низких температурах равновесия реакции смещаются вправо за счет кристаллизации солей.
Количество фтористых соединений, выделяющихся в газовую фазу, можно оценить по равновесному давлению паров НF и SiF4 над системой Н3РО4 – Н2SiF6 – Н2О. Условия, способствующие повышению парциального давления SiF4 и НF над растворами при равновесии, должны благоприятствовать увеличению выхода фтора в газовую фазу в условиях производства.
Наличие примесей в значительной степени искажает процесс выделения фтористых соединений в газовую фазу. Связывание фтора в прочные комплексы с ионами алюминия и железа, образование соединений типа фторидов алюминия, магния, кальция, а также солей кремнефтористоводородной кислоты (СаSiF6, Na2SiF6, K2SiF6, MgSiF6 и др.) способствует уменьшению выделения фтористых соединений в газовую фазу. Поэтому степень выделения фтора в газовую фазу в производственных условиях не превышает 50-55% (в пересчете на фтор, введенный с фосфатным сырьем и фосфорной кислотой).
7. Способы и параметры производства
Производство двойного суперфосфата осуществляется двумя способами:
1. полунепрерывным (камерным),
2. непрерывным (поточным).
Полунепрерывный способ сводится к камерному вызреванию, складской дообработке и последующему гранулированию порошковидного продукта.
Непрерывные способы отличаются отсутствием стадии складской дообработки. К ним относятся камерно-поточный, бескамерные (с применением барабанных и распылительных сушилок) и малоретурный (с применением аппарата БГС) способы. В настоящее время используются полунепрерывный и непрерывный малоретурный способы.
Производство двойного суперфосфата полунепрерывным камерным способом.
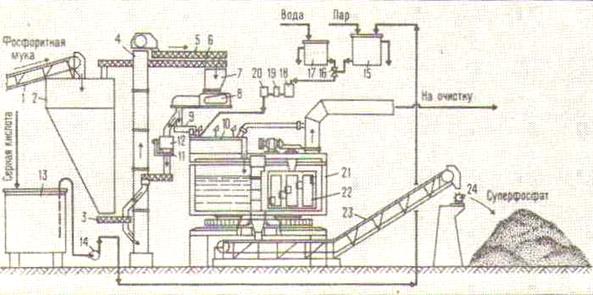
Рис. 2. Схема производства суперфосфата непрерывным способом.
1-транспортер для апатитового концентрата; 2-бункер для апатитового концентрата; 3-шнековый питатель; 4-ковшовый элеватор; 5, 9-шнеки; 6-обратный шнек для избытка апатитового концентрата; 7-бункер весового дозатора; 8-весовой дозатор; 10-смеситель; 11-контрольные весы для проверки весового дозатора; 12-бункер контрольных весов; 13-резервуар для серной кислоты; 14-центробежный кислотный насос; 15-напорный бак для кислоты; 16-кислотный смеситель; 17-напорный бак для воды; 18-газоотделитель для оксидов азота, выделяющихся при разбавлении башенной серной кислоты; 19-концентратомер для кислоты; 20-щелевой расходомер кислоты; 21-суперфосфатная камера; 22-фрейзер; 23-транспортер для камерногосуперфосфата; 24-разбрасыватель суперфосфата на складе.
Технологическая схема производства двойного суперфосфата камерным способом аналогична схеме производства простого суперфосфата (рис. 2). Основным недостатком камерного способа является выделение газообразных соединений фтора в атмосферу склада при обработке суперфосфата.
При разложении апатитового концентрата фосфорной кислотой образуется плотный и мажущийся продукт, выгрузка которого из супер фосфатной камеры и его дообработка на складе затруднительны. Поэтому для улучшения физических свойств суперфосфата в смеситель вводят молотый известняк – 3-3,5% от массы апатита, при разложении которого выделяется диоксид углерода, что придает суперфосфатной массе пористость и рыхлость.
Для связывания фтора, содержащегося в фосфорной кислоте и исходном фосфате, в смеситель может быть введен сульфат натрия в количестве, обеспечивающем связывание всей кремнефтористоводородной кислоты.
При работе на кислоте повышенной концентрации пульпа при смещении быстро густеет, перемешивание ее с известняком затрудняется, и камерный суперфосфат получается очень плотным. Суперфосфат получается плохого качества (содержит много влаги и сильно мажется) и при работе на фосфорной кислоте концентрацией ниже 51% Р2О5.
При смещении фосфорита (кингисеппского, Каратау) с фосфорной кислотой, содержащей 50-52% Р2О5, образуется быстро загустеваюшая пульпа. Подвижное состояние такой пульпы при стехиометрической норме фосфорной кислоты сохраняется в зависимости от тонины помола концентрата в пределах 0,5-2 мин. При работе на фосфорите тонкого помола (остаток на сите 0,071 мм не более 20%) разложение его идет быстрее, и пребывание суперфосфатного пирога в камере сокращается до 0,75-1 ч вместо 1,5 ч при работе на фосфорите грубого помола (остаток на сите 0,18 мм не более 20%). Понижение температуры двойного суперфосфата при складском дозревании до 40-60°С ускоряет доразложение апатита. При более высоких и более низких температурах скорость доразложения замедляется.
Охлаждение суперфосфата до оптимальной температуры достигается путем перелопачивания его на складе из одной суперфосфатной кучи в другую при помощи мостовых грейферных кранов, ковшовых экскаваторов или одновременно теми и другими средствами.
Производство гранулированного двойного суперфосфата

Рис. 3. Схема производства гранулированного суперфосфата.
1-грейферный кран; 2, 3, 9, 26, 27-бункеры; 4-дозирующий питатель; 5, 10-ленточные питатели; 6, 19-грохоты; 7, 20-дробилки; 8, 22, 24, 25-ленточные транспортеры; 11-гранулятор; 12-форсунки; 13-сушильный барабан; 14-топка; 15-циклон сухой очистки; 16-скруббер; 17-вентилятор; 18-элеватор; 21, 23-шнеки; 28-полуавтоматические весы; 29-зашивочная машина; 30-автопогрузчик
Схема получения двойного гранулированного суперфосфата приведена на рис. 3.
Вылежавшийся двойной суперфосфат измельчают в замкнутом цикле на молотковой дробилке, затем рассевают на вибрационном грохоте, после чего нейтрализуют молотымизвестняком до 2-2,5% Р2О5 (своб.). Затем нейтрализованный суперфосфат и ретур подают в гранулятор (D=1,8-2,2 м, L=8-10 м).
В грануляторе смесь увлажняют (до 18-20% Н2О) и гранулируют в течение 6-10мин. Барабан гранулятора вращается со скоростью, которая обеспечивает однородность образующихся гранул (1 м/с).
Гранулы сушат до содержания влаги 3-4%. При более высоком содержании влаги снижается прочность гранул и ухудшается рассев продукта вследствие залипания сеток грохотов. Сушить до влажности 2% и ниже нецелесообразно из-за повышения гигроскопичности продукта, имеющего кислотность 1,5-2,5% Р2О5.
Отходящие газы очищают вначале от пыли в циклонах, а затем от фтористых соединений в мокром скруббере и абсорбционной башне. При улавливании фтористых соединений аппараты орошают в замкнутом цикле через систему башня сборник – насос.
Загрязненные сточные воды, образующиеся в абсорбционных системах, собирают в общий сборник и из него перекачивают на станцию нейтрализации сточных вод, а оттуда вшламонакопитель – отстойник. Нейтрализованные осветленные сточные воды после шламонакопителя возвращают в производство.
При проведении процесса с замкнутым жидкостным циклом скрубберную жидкость из циркуляционного сборника подают на питание грануляторов (циркулирующая жидкость представляет собой разбавленный раствор кремнефтористоводородной кислоты и монокальцийфосфата, содержащий взвесь нерастворимых солей). Для поддержания постоянного уровня в циркуляционный сборник непрерывно подают воду от системы абсорбции.
Производство двойного суперфосфата по камерно-поточному способу
Камерно-поточный метод отличается от камерного отсутствием стадии вызревания продукта. В связи с этим для достижения высокой степени разложения фосфата в этом процессе применяют легкоразложимые фосфориты тонкого помола.
Способ базируется на типовом, стандартном, освоенном и надежно работающем оборудовании (суперфосфатные камеры, барабанные грануляторы и др.). Процесс может быть бессточным, так как производственные стоки могут быть использованы для увлажнения шихты при ее гранулировании.
При сушке кислого гранулированного суперфосфата происходит доразложение вторичного фосфата и одновременное снижение свободной кислотности.
Технологическая схема производства двойного суперфосфата камерно-поточным способом приведена на рис.4.

Рис. 4. Схема производства двойного гранулированного суперфосфата камерно-поточным методом.
1-бак для фосфорной кислоты; 2-насос; 3-дозатор фосфоритной муки; 4-расходомер кислоты; 5-смеситель; 6-суперфосфатная камера; 7-транспортеры; 8-ворошитель; 9-элеватор; 10-барабанный гранулятор; 11-барабанная сушилка; 12-вентиляторы; 13-топка; 14-грохот; 15-дробилка; 16-аммонизатор; 17-холодильник КС
Газообразный аммиак из аммонизатора улавливается в абсорбционной системе разбавленной фосфорной кислотой.
На 1т Р2О5 (усв.) гранулированного аммонизированного суперфосфата расходуется 824-835 кг фосфорной кислоты (100 % Р2О5); 271-280 кг фосконцентрата (100 % Р2О5); 35 кг аммиака (100% NН3).
Производство двойного гранулированного суперфосфата многоретурным способом.
В отличие от поточного метода в данном процессе исключается операция сушки пульпы в распылительной сушилке; испарение всей вносимой воды происходит в грануляторе и сушильном барабане. Многократная циркуляция ретура и наслоение пульпы на его поверхность позволяет получать плотные слоеные гранулы.
Технологическая схема производства двойного суперфосфата по ретурному способу приведена на рис. 5.

Рис. 5. Схема производства гранулированного двойного суперфосфата бескамерным способом с применением упаренной кислоты (39% Р2О5)
1-бункер для фосфата; 2-дозатор фосфата; 3-смеситель; 4-грануляторы; 5-топка; 6-сушильный барабан; 7-циклон; 8-скруббер; 9-бункер для ретура; 10-грохот
Недостатком ретурного способа является большая кратность ретура, что влечет за собой непроизводительный рост габаритов оборудования, необходимость применения мощных транспортных механизмов и излишний расход энергии.
Разложение фосфатного сырья фосфорной кислотой сопровождается обильным пенообразованием. Максимальное удаление образующегося газа из пульпы обеспечивается интенсивным перемешиванием. Этот процесс сопровождается одновременным образованием насыщенных растворов и кристаллизацией из них солей. Насыщение и кристаллизация ускоряются в случае применения фосфорной кислоты, содержащей более 35%Р2О5.
При увеличении температуры разложения от 40 до 100°С растворимость фосфатов кальция в фосфорнокислых растворах, содержащих 40%Р2О5, возрастает примерно в 2 раза, а пересыщение понижается примерно в З раза. Поэтому при разложения кингисеппского флотоконцентрата 39% (по Р2О5) фосфорной кислотой поддерживают температуру пульпы на уровне 105-110°С за счет подачи острого пара. При температуре ниже примерно 90°С пульпа, приготовленная на 39% кислоте, теряет текучесть, приобретает пастообразную консистенцию, не поддается перекачке насосами, забивает течки, лотки и трубопроводы.
Снижение нормы кислоты ниже 770 кг (100% Р2О5)на 1 тфосфата в случаеприменения 39% кислоты приводит к образованию быстро загустевающей пульпы. При этом степень разложения вторичного фосфата в пульпе при рабочих температурах будет около 40%. Увеличение нормы кислоты более 850 кг ведет к возрастанию свободной кислотности в пульпе, шихте, что осложняет процессы сушки, рассева и дробления.
Применение фосфорной кислоты концентрацией ниже 39% Р2О5 при постоянной ее норме приводит к получению пульпы с повышенным содержанием влаги, что, в свою очередь, приводит к увеличению расхода ретура. Контроль нормы фосфорной кислоты в процессе разложения фосфатного сырья ведут по содержанию воднорастворимой и свободной Р2О5 в пульпе.
Производство двойного суперфосфата поточным способом с применением распылительной сушилки
К характерным особенностям поточного способа получения двойного суперфосфата относятся:
Ø непрерывность производства,
Ø возможность проведения процесса без складской дообработки промежуточных продуктов, что позволяет исключить загрязнение атмосферы фтором,
Ø исключение необходимости упарки экстракционной фосфорной кислоты,
Ø возможность улавливания фтористых соединений в абсорбционной аппаратуре, что сводит до минимума их выбросы в атмосферу,
Ø проведение поверхностной нейтрализации продукта мелом, что позволяет получать готовый продукт с хорошими физико-химическими свойствами и достаточно высоким отношением водорастворимой Р2О5 к усвояемой (не ниже 90%),
Ø возможность использования фосфоритов различных месторождений (на второй фазе процесса).
В качестве исходного сырья для получения двойного суперфосфата используется неупаренная экстракционная фосфорная кислота из апатитового концентрата (29-32% Р2О5) и – во второй фазе – фосфориты, содержащие не ниже 28% Р2О5 и 3,5-4% полуторных окислов. При этом двойной суперфосфат содержит 42-50% Р2О5 в усвояемой форме, 5% свободной Р2О5, не более 3% влаги. При использовании фосфатного сырья с большим содержанием полуторных окислов (5-6%) отношение Р2О5 водной к усвояемой снижается до 80-85%.
Технологическая схема производства двойного суперфосфата приведена на рис. 6. Разложение фосфорита неупаренной фосфорной кислотой производят в двух последовательно установленных реакторах. При этом норма фосфорной кислоты равна 85-90 частей Р2О5 на 100 частей фосфорита, которая непрерывно поступает в первый реактор из отделения экстракции через ковшевой дозатор 4. При этом температура в реакторе поддерживается в пределах 80°С, продолжительность разложения составляет не более 60 мин, степень разложения фосфорита достигает 50-60%.

Пульпа из первого реактора поступает во второй, откуда примерно в равной пропорции она подается на сушку и гранулирование. Из второго реактора пульпа насосом 5 подается на центробежный диск 6 распылительной сушилки 7. Процесс сушки пульпы осуществляется во взвешенном состоянии топочными газами, которые поступают в объем камеры из топки через газораспределительное устройство 8. В распылительной сушилке одновременно протекают процессы сушки и дальнейшего разложения фосфорита до 80-90%. В результате чего получается мелкодисперсный продукт с содержанием влаги не более 3%, который осаждается на верхнее днище 9 и далее скребками 10 выгружается в шнек 11 под сушилкой, откуда элеватором 12 через промежуточный бункер подается в двухвальный горизонтальный смеситель 13 на грануляцию.
Производительность распылительной сушилки составляет 10-12 т пульпы в 1 ч. Температура топочных газов на входе в распылительную сушилку поддерживается 550°С, на выходе 120-130°С. Кроме того, сушильная камера оборудована газораспределительным устройством, двумя днищами для сбора сухого продукта, механическими вращающимися скребками для удаления мелкого сухого продукта и контрольно-измерительными приборами для поддержания стабильного режима. Отходящие газы из распылительной сушилки отсасываются вентилятором на очистку. Гранулирование продукта проводится в горизонтальном двухвальном смесителе, куда непрерывно поступают мелкодисперсный продукт (-1 мм) из распылительной сушилки, мелкая фракция после отсева на грохотах и пульпа из второго реактора. Из смесителя частично сгранулированная масса через течку поступает в сушильный барабан 14, откуда высушенный материал элеватором 15 подается на грохот 16 для рассева. Сушка гранул производится при температуре газов на входе в сушильный барабан порядка 550°С, на выходе 120-130 °С. После сушки отходящие газы направляются на очистку от пыли и фтористых соединений. Температура продукта на выходе из сушильного барабана 100-105oС, содержание влаги в нем до 3%.
На грохотах продукт рассевается на фракции. Фракция +1-3,2 мм направляется на охлаждение, +3,2 мм – на измельчение в дробилки 17 и вновь возвращается на повторный рассев, -1 мм поступает в двухвальный смеситель для смешения с пульпой. После рассева товарная фракция 1-3,2 мм поступает на охлаждение в холодильник кипящего слоя (КС) 18, где температура продукта снижается до 40°С. Далее охлажденный продукт нейтрализуют с поверхности мелом в количестве 5% от веса продукта. Этот процесс осуществляют в барабане-нейтрализаторе 19. Нейтрализованный продукт, содержащий 42-46% Р2О5 в усвояемой форме, не более 5% Р2О5 свободной, менее 3% влаги, при отношении Р2О5 водной к усвояемой 0,9 и более транспортером подают в бункер на склад для расфасовки и упаковки.
На действующих заводах отходящие газы от распылительной сушилки и сушильного барабана хвостовым вентилятором просасываются через систему пылеочистки, состоящей из двух последовательно установленных циклонов (D=3,2 м, L=12,12 м), и систему очистки от фторсоединений, в которую входят турбулентные скруббера Дойля, последовательно установленные две механические абсорбционные камеры и аэромикс. Очищенные газы через выхлопную трубу выбрасываются в атмосферу.
К недостаткам способа относятся: неудовлетворительное качество кремнефтористоводородной кислоты, получаемой при абсорбции фтористых соединений из газов распылительных сушилок, что делает ее ограниченно годной для переработки в квалифицированные продукты.
При снижении нормы кислоты получают готовый продукт с меньшим содержанием Р2О5 (усв.); при увеличении выше оптимальной образуется кислый продукт более 11% Р2О5 (своб.), что приводит к залипанию сеток на грохотах, транспортных средств, сушильного барабана и днищ распылительных сушилок.
При применении фосфорной кислоты с содержанием менее 29% Р2О5 образуется пульпа влажностью более 41%, что снижает производительность сушильных аппаратов. Использование фосфорной кислоты, содержащей более 34% Р2О5, приводит к затруднениям при переработке полученной пульпы на последующих стадиях. Температуру пульпы в реакторах следует поддерживать в соответствии с концентрацией используемой фосфорной кислоты. Это связано с тем, что вязкость пульпы зависит от температуры и концентрации исходной кислоты.
В процессе сушки кислых гранул происходит доразложение фосфата, подаваемого с пульпой. Поэтому нейтрализацию свободной кислоты в двойном суперфосфате одновременно с процессом гранулирования проводить нецелесообразно. При гранулировании мелкого материала, имеющего большую поверхность смачивания, подают больше пульпы на его увлажнение. В зависимости от крупности материала влажность шихты, выходящей из гранулятора, может изменяться в широких пределах.
При обработке поверхности гранул двойного суперфосфата мелом свободная кислотность нейтрализуется в основном в верхнем слое гранул с образованием монокальцийфосфата:
2Н3РО4 + СаСО3= Са(Н2РО4)2*Н2О + СО2.
В присутствии избыточного количества мела образовавшийся Са(Н2РО4)2*Н2О частично превращается в СаНРО4*2Н2О:
Са(Н2РО4)2*Н2О + СаСО3 = 2СаНРО4*2Н2О + СО2
Содержание свободного мела в готовом продукте снижается при его омасливании мазутом или минеральными маслами перед нейтрализацией.
При аммонизации гранулированного двойного суперфосфата процесс идет от поверхности гранул к ядру, поэтому в верхних слоях гранул реакция нейтрализации протекает более глубоко:
Са(Н2РО4)2*Н2О + NН3 = СаНРО4 + NН4Н2РО4 + Н2O
Мg(H2РО4)2*2Н2О + 2NН3 = NH4MgРО4 + NН4Н2РО4
По мере увеличения расхода аммиака протекают следующие реакции:
NН4Н2РО4 + NН3 = (NН4)2НРО4
ЗСаНРО4 + 2NН3 = Са3(РО4)2 + (NН4)2НРО4
Производство двойного суперфосфата поточным способом с применением БГС
Наибольшее распространение получил поточный способ производства двойного суперфосфата с применением барабанного гранулятора сушилки (БГС). В БГС совмещаются процессы грануляции и сушки, что значительно упрощает технологическую схему, а также позволяет увеличить производительность технологической линии. На рис. 7 представлена схема поточного производства двойного суперфосфата с аппаратами БГС.
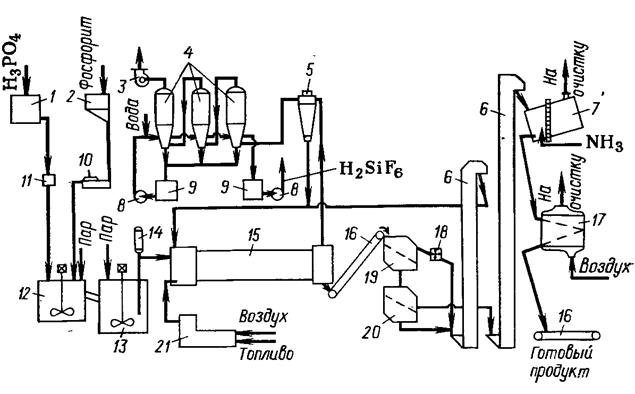
Рис. 7. Схема получения двойного суперфосфата поточным методом с применением БГС:
1-сборник фосфорной кислоты; 2-бункер фосфата; 3-вентилятор; 4-абсорберы типа Вентури; 5-одиночный циклон; 6-элеваторы; 7-аммонизатор; 8-насосы; 9-сборники; 10, 11-дозаторы; 12, 13-реакторы; 14-погружной насос; 15-аппарат БГС; 16-ленточные конвейеры; 17-холодильник КС; 18-молотковая дробилка; 19, 20-односитные грохоты; 21-топка.
Фосфоритную муку из бункера 2 весовым дозатором 10 непрерывно дозируют в реактор первой ступени 12 емкостью 40 м3. Сюда же из напорного бака 1 через дозатор 11 подают фосфорную кислоту концентрацией 35-37% Р2О5Полученная реакционная пульпа перетекает в реактор второй ступени 13 емкостью 100 м3. Реакторы снабжены трехлопастными мешалками. В оба реактора подают острый пар и поддерживают разрежение 50-100 Па. Разложение продолжается не менее 60 мин при 90-105°С.
Из реактора второй ступени пульпу влажностью 35% погружным насосом 14 подают в аппарат БГС 15, где происходит ее сушка и грануляция, сопровождающиеся дальнейшим разложением фосфата. В аппарат БГС поступает также ретур (мелкая фракция двойного суперфосфата). Отношение масс ретура и готового суперфосфата составляет 3:1.
Пульпу пневматическими форсунками разбрызгивают на завесу сухого ретура. Образование и рост гранул происходит за счет наслаивания пульпы на мелкие частицы ретура. Сушку гранул ведут топочными газами при температуре на входе в аппарат 600-700°С и на выходе 110-120°С. Высушенный продукт (не более 4% влаги) на грохотах 19 и 20 разделяют на три фракции. Крупную фракцию после измельчения в дробилке 18 смешивают с мелкой фракцией и в качестве ретура возвращают в аппарат БГС. Товарную фракцию продукта с размерами гранул 1-4 мм нейтрализуют аммиаком в барабане 7, охлаждают воздухом до 35-45°С в аппарате КС 17 и направляют на склад.
Выделяющиеся в производстве двойного суперфосфата фторсодержащие газы поглощают водой в абсорберах 4. Воздух из аммонизатора 7 очищают от аммиака фосфорной кислотой или водой.
Основное оборудование
Реакторы для разложения фосфата фосфорной кислотой имеют цилиндрическую форму. Их футеруют кислотоупорным кирпичом по подслою из листового полиизобутилена. Крышки реакторов выполняют из спецстали или углеродистой стали, гуммированной с внутренней стороны. На крышках расположены патрубки для подачи компонентов и для отсоса газов. В нижней части реактора имеется сливное отверстие. Реакторы оборудованы трехлопастными мешалками из стали ЭИ-943. Окружная скорость на концах мешалок 5-7 м/с. Мешалки подвешены на консольном валу. Пульпа перетекает из одного реактора в другой по перетоку.
Аппарат БГС(рис. 8)представляет собой барабан диаметром 3,5-4,5 м и длиной 16-18 м, установленный под углом 3° и вращающийся с частотой 4 об/мин. В зоне загрузки внутренняя поверхность барабана оснащена короткой винтовой насадкой 3, а на остальной длине барабана — подъемно-лопастной насадкой 4 Г-образной формы и обратным шнеком 5. Подъемно-лопастная насадка создает во вращающемся аппарате завесу материала, ссыпающегося с лопаток. Усеченный конус 7, обращенный меньшим основанием в сторону выгрузки, обеспечивает необходимое заполнение барабана продуктом и одновременно служит устройством для отделения мелкой фракции гранул, которую обратным шнеком возвращают на гранулирование. БГС различаются конструкцией обратного шнека (открытый или закрытый) и размерами. Производительность аппарата по двойному суперфосфату 40 т/ч.
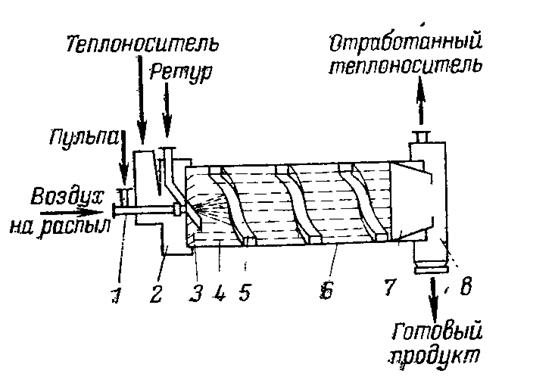
Рис. 8. Аппарат БГС:
1-форсунка; 2-загрузочная камера; 3-винтовая питающая насадка; 4-подъемно-лопастная насадка; 5-обратный шнек; 6-корпус аппарата; 7-конус; 8-разгрузочная камера.
8. Технологические расчеты
Составить материальный расчет производства двойного суперфосфата из неупаренной фосфорной кислоты.
Исходные данные:
в качестве вторичного фосфата используют фосфорит, содержащий 21,6% Р2О5, 2,15% фтора, 4,25% СО2 и 10,5% Ме2О3; экстракционная кислота (32% Р2О5) содержит 1,92% фтора и 7,5 кг/м3 гипса;
на 100 кг фосфоритной муки расходуется 75 кг Р2О5, содержащегося в фосфорной кислоте;
выход ненейтрализованного суперфосфата на 100 кг фосфоритной муки составляет 210 кг (без учета золы, вносимой топливом при сушке, и гипса, содержащегося в фосфорной кислоте);
состав ненейтрализованного продукта:
 - 45,3%;
- 45,3%;  - 44,7%;
- 44,7%;  - 7%;
- 7%;
степень использования Фосфорита 94%;
отношение ретура к ненейтрализованному продукту 4: 1;
степень выделения в газовую фазу:
фтора – 22%; СО2 – 100%; испаряется воды (при смещении) 1,7 кг на 100 кг фосфорита;
гранулометрический состав продукта:
+4 мм – 34%; -4 – +1 мм – 53%; -1 мм – 13%;
нейтрализацию производят известняком до содержания 4%  ;
;
степень использования известняка, содержащего 95% СаСО3, составляет 70%;
количество золы, вносимой в продукт при сушке, 20% от содержания его в топливе, что составляет 2,59 кг на 100 кг фосфорита;
механические потери 1%.
Расчет составляет на 100 кг вторичного фосфата.
Решение.
Смешение и получение пульпы
Для проведения реакции необходимо фосфорной кислоты
(32% Р2О5):

В этом количестве кислоты содержится гипса:

1320 – плотность кислоты, кг/м3
Следовательно, необходимая масса кислоты:

Общая масса, поступающая на смешение:
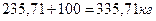
При взаимодействии фосфорной кислоты с фосфоритом испаряется Н2О 1,7 кг и выделяется вся СО2, т. е. 4,25 кг. Следовательно, количество пульпы, полученной при смешении реагентов и поступающей на смешение с ретуром, составляет:

Смешение пульпы с ретуром и сушка
В процессе сушки при условии пренебрежения выделением фтора при получении пульпы выделяется фтора:
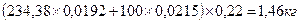
В пересчете на SiF4 это составляет:

Выход готового продукта с учетом гипса, содержащегося в кислоте (без учета золы топлива), равен:

210 и 1,33 – выход суперфосфата и количество гипса, поступающего с фосфорной кислотой.
В процессе сушки выделяется воды:
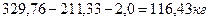
Это соответствует объему образующегося водяного пара, равному при н. у. 144,9 м3.
Количество ретура, подаваемого на смешение с пульпой:
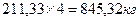
Общее количество материала, направляемое в смеситель-гранулятор:
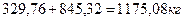
Содержание влаги в поступающем материале, удаляемой при сушке:

Количество материала, выходящего из сушильного барабана без учета золы:

Рассев и дробление
Из сушильного барабана на рассев поступает:

Где 2,59 – количество золы (из условия).
Содержание отдельных фракций в рассеянном материале, кг:
частиц с размерами > 4 мм

частиц с размерами >1 и <4 мм

частиц с размерами <1 мм

Количество материала, поступающего на дробление, равно 360,14 кг.
Нейтрализация двойного суперфосфата
Расчет производим при допущении, что остаточное содержание  относится к ненейтрализованному материалу. В действительности количество нейтрализованного суперфосфата больше и, следовательно, содержание
относится к ненейтрализованному материалу. В действительности количество нейтрализованного суперфосфата больше и, следовательно, содержание  в продукте будет несколько меньше 4%.
в продукте будет несколько меньше 4%.
Необходимо нейтрализовать  :
:

Согласно реакции
Р2О5 + СаСО3 + ЗН2О = Са(Н2РО4)2*Н2О + СО2
для нейтрализации необходимого известняка:

При нейтрализации выделится СО2:

Расход известняка в натуре с учетом содержания в нем СаСО3 и степени его использования:

Выход готового продукта:
Дата добавления: 2015-07-20; просмотров: 92 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Двойной стабилизатор на классику ваз | | | Таблицы и графики АЧХ и ФЧХ |