
Читайте также:
|
Растворимость вещества – это способность вещества растворяться в том или ином растворителе до образования насыщенного раствора.
Количественно растворимость выражается коэффициентом растворимости – это есть масса вещества, способного растворяться в 100 граммах растворителя. Для газов иногда коэффициент растворимости выражают в мл газа, способного раствориться в 100 г растворителя (или в 1 литре растворителя) при данной температуре и давлении.
Растворимость веществ зависит от следующих факторов:
1) от природы растворенного вещества и природы растворителя. В этом случае полярные вещества (HCl, NaCl) лучше растворяются в полярных растворителях (вода), а неполярные вещества лучше растворяются в неполярных или малополярных растворителях.
2) от температуры. С повышением температуры путем нагревания растворимость большинства твердых веществ, как правило, увеличивается. Растворимость газов (Н2, О2) в воде с повышением температуры уменьшается.
3) от давления (для растворимости газов).
Влияние давления на растворимость газов в жидкости описывается законом Генри:
Растворимость газа в жидкости прямо пропорциональна давлению этого газа над жидкостью.
с = К×р,
где р – давление газа (например, О2) над жидкостью (например, водой); с – растворимость газа, то есть число граммов газа в единице объема жидкости; К – коэффициент пропорциональности, называемый константой Генри. Он характеризует растворяющуюся способность данного газа: чем больше «К», тем данный газ лучше растворяется в данной жидкости.
Зависимость растворимости газовой смеси (например, О2 и N2 воздуха) в жидкости от парциального давления газа в этой смеси выражает закон Генри-Дальтона:
Растворимость каждого компонента газовой смеси прямо пропорциональна парциальному давлению этого компонента в газовой смеси.
сi = Кi × рi,
где сi – растворимость i-того компонента;
рi – парциальное давление i-того компонента в газовой смеси.
Например, если газовая смесь состоит из О2 и N2, то можно написать:
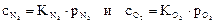
Из закона Генри-Дальтона следует, что чем больше парциальное давление компонента в газовой смеси, тем больше его растворимость в жидкости (например, воде).
Присутствие электролита (NaCl, NaOH) в воде уменьшает растворимость газов. Зависимость растворимости газа от концентрации электролита в растворе выражает закон И.М. Сеченова:
Дата добавления: 2015-07-25; просмотров: 73 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Изменение энергии Гиббса, энтальпии и энтропии при образовании раствора. | | | Лекция 14. Свойства растворов неэлектролитов |