
|
Читайте также: |
а) Названия бескислородных кислот составляют из
названия элемента + О + слово «водородная»:
НCl – хлороводородная кислота, H2S – сероводородная кислота, HCN – циановодородная кислота, HI – йодоводородная кислота.
б) Названия кислородсодержащих кислот образуют от
русского названия элемента + «кислота».
При этом название кислоты, в которой элемент имеет высшую степень окисления, оканчивается на –ная или -овая (H2SO4 – серная кислота, HClO4- хлорная кислота, H3AsO4 – мышьяковая кислота). С понижением степени окисления элемента окончания изменяются так: - оватая (HСlO3 – хлорноватая кислота), -истая (HСlO2 – хлористая кислота), -оватистая (HOCl – хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающей низшей степени окисления, получает окончание –истая (HNO3 – азотная кислота, HNO2 – азотистая кислота)
Кислотные остатки. Отрицательно заряженные группы атомов и одиночные атомы (отрицательные ионы), которые остаются после отрываот молекулы кислоты одного или нескольких атомов водорода, называются кислотными остатками.
Величина отрицательного заряда кислотного остатка определяется числом атомов водорода, замещенных металлом (табл.15).
Таблица 15. Названия и формулы некоторых кислотных остатков.
| Формула кислоты | Название кислоты | Кислотный остаток | Название кислотного остатка | |
| HCl | Хлороводородная (соляная) | Cl- | Хлорид-ион | |
| HBr | Бромоводородная | Br- | Бромид-ион | |
| HI | Йодоводородная | I- | Йодид-ион | |
| H2S | Сероводородная | HS- | Гидросульфид-ион | |
| S2- | Сульфид-ион | |||
| HClO | Хлорноватистая | ClO- | Гипохлорит-ион | |
| HClO2 | Хлористая | ClO 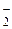
| Хлорит-ион | |
| HClO3 | Хлорноватая | ClO 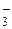
| Хлорат-ион | |
| HClO4 | Хлорная | ClO 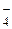
| Перхлорат-ион | |
| H2SO3 | Сернистая | HSO 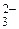
| Гидросульфит-ион | |
SO 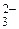
| Сульфит-ион | |||
| H2SO4 | Серная | HSO 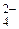
| Гидросульфат-ион | |
SO 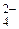
| Сульфат-ион | |||
| HNO2 | Азотистая | NO 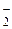
| Нитрит-ион | |
| HNO3 | Азотная | 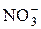
| Нитрат-ион | |
| H3PO4 | Ортофосфорная | 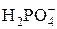
| Дигидрофосфат-ион | |
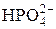
| Гидрофосфат-ион | |||
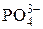
| Ортофосфат-ион | |||
| H2CO3 | Угольная | 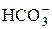
| Гидрокарбонат-ион | |
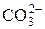
| Карбонат-ион | |||
| H2SiO3 | Кремниевая | 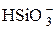
| Гидросиликат-ион | |
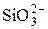
| Силикат-ион | |||
| HMnO4 | Марганцовая | 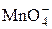
| Перманганат-ион | |
| H3BO3 | Борная (ортоборная) | 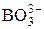
| Борат-ион | |
| H2CrO4 | Хроматы | 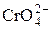
| Хромат-ион | |
| H2Cr2O7 | Дихромовая | 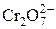
| Дихромат-ион | |
| HCN | Циановодородная | 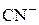
| Цианид-ион |
Дата добавления: 2015-07-25; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Получение и свойства оксидов | | | Получение и свойства кислот |