
|
Читайте также: |
УЧИТЕЛЬ. Мы с вами изучили тему "Периодический закон и строение атома", имеем представление о химической связи, познакомились типами и видами химической связи.
Вопросы к классу:
1. Что называется химической связью?
2. Какие типы химической связи вы знаете?
3. Какие виды ковалентной связи вам известны?
4. Для того чтобы определить вид ковалентной связи мы пользуемся понятием "электроотрицательность". Дайте определение этого понятия.
Используя знания о строении атомов, типах и видах химической связи, попытаемся установить причинно-следстенные связи между ними.
(Школьники отвечают, и учитель открывает часть таблицы №1)
Таблица 1
| Строение атомов химических элементов | Типы химической связи между ними |
 Причина следствие Причина следствие
|
А теперь выполняем задание №1. Определить тип химической связи и составить схему образования связи в соединениях:
1-я группа – PCl3
·· ··
: Cl:: Cl:
 ··: ·· ··: ··
··: ·· ··: ··


 (: Cl ·· P ·· Cl:: Cl ·· P ·· Cl:)
(: Cl ·· P ·· Cl:: Cl ·· P ·· Cl:)
·· ·· ·· ·· ·· ··
2-я группа – O2
·· ·· ·· ··
 (: O · + · O:: O (::) O:)
(: O · + · O:: O (::) O:)
ֹ ֹ

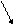 3-я группа – CaCl2 ·· ··
3-я группа – CaCl2 ·· ··
(Ca: + · Cl: Ca2+[: Cl: ]¯2).
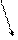 ·· ··
·· ··
··
· Cl:
··
4-я группа – NH3, O2 (на магнитной доске схематично изобразить строение молекул).
Представитель от каждой группы выполняет задание у доски, в это время остальные ученики выполняют лабораторную работу.
Лабораторная работа. Составить шаро-стержневые модели молекул:
1-я группа – CH4.
2-я группа – H2O.
3-я группа – F2.
4-я группа – NaCl.
Затем идёт проверка выполнения заданий №1 и лабораторной работы.
УЧИТЕЛЬ. Вы все готовили к уроку творческие задания: сочиняли сказки, загадки, стихи, готовили пантомимы по теме "Химическая связь". Давайте послушаем и посмотрим некоторые отчёты по творческим заданиям и ответим на вопрос: о каком виде химической связи идёт речь?
ПЕРВЫЙ УЧЕНИК. СКАЗКА О ЖАДНОМ ХЛОРЕ.
В некотором царстве, химическом государстве, жил-был Хлор. И хотя принадлежал он к старинному роду Галогенов, да и наследство получил немалое, на внешнем энергетическом уровне было у него семь электронов, был он очень жадным и завистливым, а от злости стал даже жёлто-зелёным. Днём и ночью мучило его одно желание: сделаться похожим на Аргон. Он не раз слышал, как все хвалили его соседа за благородство, независимый нрав, умение владеть собой, и ещё больше зеленел от зависти. Стал он думать, как сделаться похожим на Аргон. Думал он, думал, и, наконец, придумал. "У Аргона на внешнем уровне восемь электронов, а у меня только семь, - рассуждал Хлор. – Значит, мне надо заполучить ещё один электрон, тогда я тоже буду благородным".
На следующий день собрался Хлор в дорогу за заветным электроном, но далеко идти ему не пришлось: возле самого дома встретил он атом, похожий на него как две капли воды.
- Слушай, брат, дай мне свой электрон, - заговорил Хлор.
- Нет уж, лучше ты мне дай электрон, - ответил близнец.
- Ладно, давай тогда объединим наши электроны, чтобы никому не было обидно, - сказал жадный Хлор, надеясь, что потом он заберёт электрон себе.
Но не тут-то было: оба атома в равной степени пользовались общими электронами, несмотря на отчаянные усилия жадного Хлора перетянуть их на свою сторону. Тот, второй, был той же породы.
Не добившись своего, пошёл Хлор дальше искать кого-либо послабее. Вскоре повстречался ему Водород, самый маленький, самый лёгкий из всех жителей царства. Уж у этого я запросто отниму электрон! – обрадовался Хлор. Доверчивый малыш не отказался образовать общую электронную пару, ведь он был очень скромным (для полного счастья ему хватило бы и двух электронов). Хлор сразу же бесцеремонно оттащил пару электронов к себе и лишь изредка отпускал их побегать возле ядра Водорода. Непритязательный Водород был доволен и этим, но Хлору этого было мало. И когда он окончательно убедился, что, несмотря на тщедушность Водорода, полностью отобрать у него электрон не удастся, двинулся дальше на поиски очередной жертвы.
Видит: у дороги сидит Калий из древнего, но разорившегося рода Щёлочных Металлов. "Ну, этого я точно обману! Ведь Калий и вся его родня, известные простофили", - подумал Хлор. Калий – добрая душа, не раздумывая, подарил свой единственный электрон с внешнего уровня Хлору. Недаром в народе говорят: тот, кто имеет меньше, отдаёт тем, кто имеет больше.
"Наконец-то я стал благородным! Я свободен и независим!" – воскликнул Хлор. Но как он ошибался! В тот же миг, получив от Калия его электрон, он перестал быть прежним атомом: он превратился в отрицательный ион. Мало этого! Презираемый им Калий ни за что не хотел расстаться с ним. Так до конца своих дней и таскал за собой анион Хлора ненавистный ему катион Калия…
Может, судьба Хлора сложилась бы иначе, если бы помнил он народную мудрость: чужое добро впрок не идёт.
ВТРОЙ УЧЕНИК. ИСТОРИЯ ХИМИЧЕСКОГО ГОСУДАРСТВА.
Много-много лет назад было создано химическое государство злым угнетателем Металлов королём Фтором.
При короле Фторе была шайка Неметаллов, паразитирующих и угнетающих Металлы. Доверчивые Металлы, имеющие за душой только один или два электрона, обирались Неметаллами до нитки и становились положительно заряженными ионами. Более богатые Неметаллы угнетали более бедных и брали с них высокие налоги.
Сохранилась старинная гравюра, изображающая Литий, порабощённый Фтором:
ТРЕТИЙ УЧЕНИК. ОКСИД КАЛЬЦИЯ (НЕГАШЁНАЯ ИЗВЕСТЬ)
Кальций был металлом щёлочно-земельным
И стоял в подгруппе главной
Со второй валентностью.
Кислород же там летал
И всех в таблице окислял.
Он и в группе был шестой,
Но с валентностью второй.
Как-то раз наш кислород
Предложил пойти в поход.
Тут наш Кальций согласился,
К Кислороду он сместился.
И они пошли в поход,
Через группы и ряды,
Через периоды прошли.
Кислород тут стал бурчать
И на Кальция ворчать.
Кальций сразу в позу встал.
Кислород его окислил,
Отобрав два электрона.
Кальций сразу стал ионом
Но каким он стал ионом?
Вам и надо тут сказать.
Получилась известь наша
Негашёная, но всё же!
ЧЕТВЁРТЫЙ УЧЕНИК. СКАЗКА.
Жил-был Водород. Всё у него было: и машина, и гараж, и трёхкомнатная квартира в семиэтажном доме на первом этаже.
Жил бы Водород и сейчас, но взбрело ему в голову, чтобы стать весомее в химическом государстве, надо приобрести ему один электрон. И вспомнил Водород про своего приятеля Азота. Подумав, он пошёл к Азоту, взяв с собой двух своих братьев из семьи Водородовых. Встреча прошла прекрасно, при этом образовалось соединение с валентным углов 107 градусов. Только вот забыл Водород, как называется его соединение с Азотом. Ребята, напомните ему, пожалуйста! Благодаря какой химической связи образовалось новое соединение?
ПЯТЫЙ УЧЕНИК. ТРАГИЧЕСКАЯ СУДЬБА ХЛРОВОДОРОДОВЫХ.
Жили-были Хлорина и Водород. Однажды ночью Водород сделал предложение Хлорине, она согласилась. Обвенчаться они хотели сейчас же, но было темно, поэтому им пришлось ждать до утра. И вот при дневном свете в 1772 году они обвенчались. Их священником был Джозеф Пристли. Хлорина, отличавшаяся большей электроотрицательностью, стала оттягивать у Водорода его единственный электрон. Водород захотел порвать всякую связь со своей новой женой, но не смог. Венчание происходило на улице. Молодожёны Хлороводородовы вдруг начали дымить. Ища спасения, супруги бросились в реку. Растворившись, они образовали Соляную Кислоту.
ШЕСТОЙ И СЕДЬМОЙ УЧЕНИКИ под музыку демонстрируют образование молекулы кислорода O2.
ВОСЬМОЙ И ДЕВЯТЫЙ УЧЕНИКИ - HCl
ДЕСЯТЫЙ И ОДИННАДЦАТЫЙ УЧЕНИКИ - NaCl. У них на груди приколоты таблички, демонстрирующие число валентных электронов, а в руках – надувные шары, показывающие число неспаренных электронов. Взявшись за руки, они демонстрируют образование в случае ковалентной связи общих электронных пар. В случае ионной связи один из учеников (Хлор) забирает шар (валентный электрон) у другого (Натрия).
УЧИТЕЛЬ. Итак, я вижу, что вы хорошо разобрались в типах и видах химической связи. Эти знания пригодятся вам при изучении новой темы: "Кристаллические решётки".
Ученики записывают в тетради название темы урока.
Основная часть
УЧИТЕЛЬ. Мир веществ велик и разнообразен. Они обладают самыми разными свойствами. Мы с вами выделяли физические и химические свойства веществ. Какие свойства мы относим к физическим? Используя справочники и дополнительную литературу, выполните задание №2.
Задание №2. опишите физические свойства данных веществ:
1-я группа - O2.
2-я группа - H2O.
3-я группа - NaCl.
4-я группа - графит.
Ученики заполняют таблицу №2
 Физические свойства различных веществ Таблица №2
Физические свойства различных веществ Таблица №2
| Вещества Физичес кие свойства | Кислород (О2) | Вода (Н2О) | Хлорид натрия (NaCl) | Графит (C) |
| Агрегатное состояние | Газообразное | Жидкое | Твёрдое | Твёрдое |
| Цвет | Бесцветный | Бесцветный | Белый | Чёрный |
| Плотность (г/см3) | 1,429 | 1,000 | 2,165 | 2,265 |
| Температура плавления (0С) | -218,8 | 0,0 | +801,0 | __ |
| Температура кипения (0С) | -182,97 | +100,0 | +1465,0 | +3700,0 (температура возгонки) |
| Растворимость в воде | Малорастворим | Не имеет смысла | растворим | Не растворим |
| Электропроводность | Не проводит электрического тока | Слабо проводит электрический ток | Раствор и рас- плав проводят электрический ток | Проводит электрический ток |
Дата добавления: 2015-07-11; просмотров: 67 | Нарушение авторских прав