
Читайте также:
|
Первопричиной коррозии металлов является их термодинамическая неустойчивость в различных средах при данных внешних условиях. Термодинамика определяет возможность или невозможность самопроизвольного протекания коррозионного процесса при определенных условиях.
Скорость коррозионного процесса может быть представлена в общем виде с помощью уравнения:
Скорость коррозии (СК)=.ДСП / ТП
ДСП - движущая сила процесса
ТП - Торможение процесса
ДСП может быть определена с помощью термодинамики. ТП не может быть определено термодинамически, однако с помощью термодинамики можно оценить условия, уменьшающие или исключающие протекание процесса (применение защитных сред, катодная защита, обескислороживание и др.).
Независимо от механизма коррозии возможность ее протекания определяется знаком изменения термодинамического потенциала. Процессы коррозии наиболее часто описывают изменением изобарно-изотермического потенциала – энергии Гиббса.
Любое изменение энергии системы характеризует переход ее в новое состояние и является мерой стабильности системы:
ΔG = GII -GI,
где ΔG – энергия, израсходованная на изменение состояния системы, например, на процесс коррозии; GI - энергия системы в исходном состоянии, например, металла в конкретных условиях; GII - энергия системы в новом состоянии, например, прокорродировавшего металла.
Очевидно, что при ΔG = 0 система находится в равновесии; при ΔG < 0 процесс коррозии возможен; при ΔG > 0 процесс коррозии невозможен.
20 Биокоррозия (биологическаякоррозия) - тип коррозионного разрушения в условиях воздействия микроорганизмов. Продукты жизнедеятельности различных микроорганизмов, которые присутствуют в воде, грунте, интенсифицируют процесс коррозии.
Биокоррозию можно рассматривать, как самостоятельный вид разрушения, но чаще всего процессы биологической коррозии протекают параллельно с другими, например, почвенной (грунтовой), морской, атмосферной, коррозией в неэлектролитах, водных растворах.
Повреждениям от биокоррозии подвергаются различные подземные конструкции (трубопроводы, резервуары, сваи, метро и т.п.), сооружения и трубопроводы, находящиеся в воде. Биокоррозия – неотъемный спутник нефте- и газопромышленности.
Первые догадки о влиянии на процесс коррозионного разрушения биологических организмов появились только в конце ХIХ века.
В результате протекания биокоррозии на поверхности металла появляются небольшие углубления (блестящие либо шероховатые), раковины, неровности, которые могут быть заполнены продуктами коррозии. Биокоррозия в большинстве случаев носит язвенный либо питтинговыйхарактер. Чаще всего биокоррозия является локальным разрушением.
21 Технологические методы защиты от коррозии. При производстве художественных изделий из металла технологические методы защиты от коррозии неразрывно связаны с декоративной отделкой изделий. Как правило, в художественной промышленности применяются только такие технологические методы борьбы с коррозией, которые одновременно являются и декоративной отделкой. Поэтому благодаря применению того или иного приема защиты от коррозии художественные изделия не только не теряют своего внешнего вида, а, напротив, приобретают новые художественные качества — цвет, блеск и т.п.
Основными технологическими методами защиты художественных изделий от коррозии являются:
а) легирование — введение в корродирующие металлы и сплавы при их производстве дополнительных элементов, сообщающих всему сплаву стойкость против коррозии, например хромонике-левые стали (нержавеющие стали);
б) оксидирование — искусственное образование химическим путем на поверхности изделий стойких пленок, защищающих их от коррозии;
в) металлические покрытия — способ, когда сплавы и металлы, менее стойкие против коррозии, закрывают более стойкими и, кроме того, обычно более декоративными, например хромирование, никелирование, золочение и др.;
г) неметаллические покрытия изолируют металлические изделия от внешней среды и тем самым препятствуют возникновению и развитию коррозии.
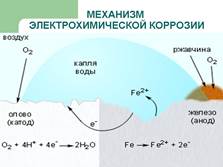
22 Электрохимическая коррозия протекает в проводящих средах и включает в себя анодные и катодные процессы. Электрохимическая коррозия может протекать не только в среде растворов электролитов, но в среде влажного воздуха.
Механизм: Поверхность металла, находящегося во влажном воздухе, адсорбирует влагу из атмосферы и покрывается тонкой пленкой воды, содержащей атмосферные газы (О2, СО2, SO2 и др.) и, следовательно, обладающей заметной ионной проводимостью. Ионы металла переходят в раствор, образуется двойной электрический слой, и разность потенциалов. Если в контакте находятся два различных металла, то возникает гальванический элемент, работа которого проводит к разрушению материала анода. Роль второго металла могут выполнять микрокристаллы примесей, содержащихся в основном металле. Так, железо и его сплавы практически всегда содержат различные соединения железа с углеродом (например, Fe3C – цементит). Кристаллы железа исполняют роль анода, на котором протекает реакция:
Fe – 2e- → Fe2+,
Далее возможно протекание побочных процессов:
Fe2+ +2OH- → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Микроскопические кристаллы железа и примесей образуют огромное количество гальванических элементов, работа которых будет сопровождаться разрушением металла и образованием ржавчины xFeO.yFe2O3.zH2O. Рыхлый слой ржавчины не предохраняет металл от дальнейшей коррозии, и процесс идет до полного разрушения материала.
Реакция восстановления кислорода протекает по приведенной выше схеме в щелочной или нейтральной среде. В кислой среде:
О2 + 4Н+ + 4е-→ 2Н2О
и выделение водорода
2Н+ + 2е- → Н2
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозий с выделением водорода или коррозией с водородной деполяризацией.
23 Блуждающие токи – токи в земле, возникающие вследствие работы посторонних источников постоянного или переменного тока (электрифицированный транспорт, сварочные агрегаты, устройства электрохимической защиты посторонних сооружений и пр.).
Процессы коррозии металла в поле блуждающих токов.Процесс коррозии металла в поле блуждающих токов является процессом электролитическим. Металл подвержен действию электролиза. Скорость процесса коррозии, как это следует из закона Фарадея, определяется количеством электричества, протекающего между анодами катодами уложенного в грунт трубопровода, и зависит от электрического сопротивления грунта и природы процессов, происходящих на анодных и катодных участках нефтепровода. Следовательно, если кроме почвенной коррозии трубопровод подвергается дополнительному воздействию блуждающих токов, то в местах, где складывается электролитическое действие этих токов с токами гальванических пар, может произойти резкое увеличение скорости коррозионных процессов.
Основными источниками являются рельсовые сети электрифицированной железной дороги, а также линии электропередач постоянного тока (ЛЭП ПТ) и катодные установки.
24 Экономические потери от коррозии металлов огромны. В США по последним данным NACE ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд. долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.
Ржавчина является одной из наиболее распространенных причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к друга конструкционных деталей. Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не были почищен, а сточные воды проникли в опоры моста. 15 декабря 1967 года Серебряный мост, соединяющий Поинт Плезант, штат Западная Виржиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьезно пострадали. Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виржинией и Огайо. Причиной обрушения стала коррозия.
Дата добавления: 2015-07-11; просмотров: 249 | Нарушение авторских прав