
|
Читайте также: |
Пример 1. Определите, удовлетворяет ли условию сплошности пленки оксидов на железе, плотность которого составляет 7,86 г/см3. На воздухе при нагревании железо покрывается продуктами газовой коррозии, состоящей из оксидов железа FeO, Fe3O4 и Fe2O3, плотности которых составляют 5,7; 5,2; 5,24 г/см3 соответственно.
Решение. Используя уравнение (7.2), находим соотношение объемов оксида и металла:
1) для оксида FeO
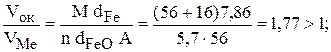
2) для оксида Fe3O4
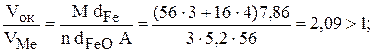
3) для оксида Fe2O3
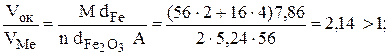
Итак, пленки всех трех оксидов удовлетворяют условию сплошности (см. уравнение 7.3). Эти оксидные пленки обладают хорошими защитными свойствами.
Пример 2. Покажите, какие из нижеперечисленных металлов: а) Zn; б) Fe; в) Сu; г) Сd; д) Ag – способны подвергаться коррозии в соляной кислоте.
Решение. Коррозия должна протекать по электрохимическому механизму, так как соляная кислота – сильный электролит. В кислотах окислителем является чаще всего Н+-ион. Определяем возможность коррозии, сравнивая электродные потенциалы всех перечисленных металлов (табл. 1 приложения) с электродными потенциалами окислителя. При рН = 0 (кислая среда) в стандартных условиях
(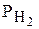 = 1 атм)
= 1 атм) 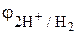 = 0,0 В (табл. 2 приложения).
= 0,0 В (табл. 2 приложения).
Следовательно, согласно уравнению (5) коррозии будут подвергаться все металлы, у которых 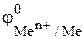 < 0. Это Zn, Fe; и Сd. Устойчивыми к кислотной коррозии будут Сu и Ag.
< 0. Это Zn, Fe; и Сd. Устойчивыми к кислотной коррозии будут Сu и Ag.
Пример 3. Покажите, какие процессы протекают при коррозии цинка в контакте с железом в соляной кислоте в условиях воздуха.
Решение. На поверхности раздела металл–раствор имеются участки металлического цинка и металлического железа. Определим, какой металл легче окисляется. С термодинамической точки зрения цинк окисляется легче, чем железо, что показывает сравнение их электродных потенциалов: 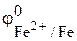 = –0,44 В,
= –0,44 В, 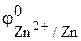 = –0,76 В (табл. 1 приложения). Поэтому процесс окисления (анодный процесс) локализуется на поверхности цинка:
= –0,76 В (табл. 1 приложения). Поэтому процесс окисления (анодный процесс) локализуется на поверхности цинка:
А. Zn – 2ē ® Zn2+,
что приводит к его разрушению.
Окислитель – ион Н+ из раствора соляной кислоты. При сравнении электродных потенциалов окислителя и восстановителя видно, что 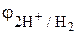 =
=
= +0,186 В > 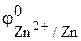 = –0,76 В, т. е. согласно уравнению (5) процесс коррозии цинка возможен.
= –0,76 В, т. е. согласно уравнению (5) процесс коррозии цинка возможен.
Катодный процесс – восстановление ионов водорода:
К. 2Н+ + 2ē ® Н2
– локализуется там, где он протекает с наибольшей скоростью, т. е. где наименьшее перенапряжение выделения водорода: 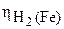 = 0,36 В;
= 0,36 В; 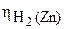 = 0,83 В (табл. 6 приложения).
= 0,83 В (табл. 6 приложения).
Сравниваем электродные потенциалы окислителя, т. е. катодного процесса восстановления ионов водорода на железе и на цинке, используя уравнение (2) и данные табл. 2 и 6 приложения:
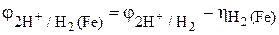 = 0,186 – 0,36 = –0,174 В;
= 0,186 – 0,36 = –0,174 В;
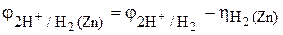 = 0,186 – 0,83 = –0,644 В.
= 0,186 – 0,83 = –0,644 В.
Поскольку электродный потенциал окислителя, т. е. катодного процесса восстановления ионов Н+ на железе более положительный, чем потенциал восстановления ионов Н+ на цинке, то катодный процесс локализуется на железе. Скорость катодного процесса на железе выше, чем на цинке, поэтому общая скорость коррозии цинка, находящегося в контакт с железом в кислой среде, намного выше, чем чистого цинка.
Пример 4. Коррозия железа в растворе соли ZnCl2 протекает с водородной деполяризацией. Объясните это явление. Напишите соответствующие уравнения реакций.
Решение. Электродный потенциал окислителя (ионов цинка) 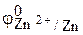 =
=
= –0,76 В, более отрицательный, чем электродный потенциал восстановителя – железа, 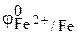 = –0,44 В (табл. 1 приложения), поэтому железо не восстанавливает металлического цинка из раствора ZnCl2. Соль ZnCl2, образованная сильной кислотой и слабым основанием, подвергается гидролизу по катиону:
= –0,44 В (табл. 1 приложения), поэтому железо не восстанавливает металлического цинка из раствора ZnCl2. Соль ZnCl2, образованная сильной кислотой и слабым основанием, подвергается гидролизу по катиону:
ZnCl2 + H2О ® ZnOHCl + HCl;
Zn2+ + HОH ® ZnOH+ + H+; рН < 7.
Вследствие гидролиза раствор соли ZnCl2 обладает кислыми свойствами. В кислоте окислителем является ион Н+. Электродный потенциал окислителя в атмосфере воздуха 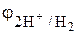 = 0,186 В (табл. 2 приложения), больше потенциала восстановителя – железа, поэтому согласно уравнению (7.5) коррозия железа в растворе ZnCl2 термодинамически возможна.
= 0,186 В (табл. 2 приложения), больше потенциала восстановителя – железа, поэтому согласно уравнению (7.5) коррозия железа в растворе ZnCl2 термодинамически возможна.
Коррозионный процесс описывается уравнениями:
| А. Fe – 2ē ® Fe2+; |
| К. Fe, 2Н+ + 2ē ® Н2. |
Анодные и катодные участки локализуются на железе.
Пример 5. Покажите, какие процессы протекают при коррозии марганца в соляной кислоте. Как изменится скорость коррозии марганца, если к кислоте добавить раствор соли Pb(NO3)2. Напишите уравнения анодных и катодных процессов, протекающих на воздухе при коррозии: а) марганца в соляной кислоте; б) марганца в кислоте в присутствии соли Pb(NO3)2. Обоснуйте протекание этих процессов, используя данные табл. 1, 2 и 6 приложения.
Решение. Восстановитель – марганец 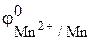 = –1,18 В, окислитель – ионы водорода кислоты,
= –1,18 В, окислитель – ионы водорода кислоты, 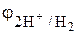 = 0,186 В (табл. 1, 2 приложения). Коррозия термодинамически возможна, так как jвос-ля < jок-ля.
= 0,186 В (табл. 1, 2 приложения). Коррозия термодинамически возможна, так как jвос-ля < jок-ля.
Анодные и катодные участки локализуются в случае а) на марганце. Коррозионный процесс описывается уравнениями:
| А. Mn – 2ē ® Mn2+; |
| К. Mn, 2Н+ + 2ē ® Н2. |
В случае б) марганец вытесняет из раствора соли Pb(NO3)2 металлический свинец, так как 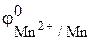 = –1,18 <
= –1,18 < 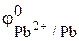 = –0,13 (табл. 1 приложения). Протекающая окислительно-восстановительная реакция описывается уравнением
= –0,13 (табл. 1 приложения). Протекающая окислительно-восстановительная реакция описывается уравнением
| Mn + Pb2+ ® Mn2+ + Pb. |
Губчатая пленка металлического свинца на поверхности марганца экранирует марганец от действия окружающей среды (кислоты) и способствует возникновению контакта Mn/Pb в кислоте. При этом марганец работает анодом и растворяется:
| А. Mn – 2ē ® Mn2+. |
Катодный процесс (процесс восстановления)
| К. 2Н+ + 2ē ® Н2 |
протекает с большей скоростью тоже на Mn, так как 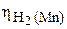 = 0,5 <<
= 0,5 << 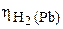 = 1,23 В (табл. 6 приложения). Но поскольку поверхность марганца экранирована металлическим свинцом, а скорость выделения водорода на свинце очень мала, то в целом скорость коррозии (окисления) марганца в кислоте при добавлении раствора нитрата свинца резко уменьшается.
= 1,23 В (табл. 6 приложения). Но поскольку поверхность марганца экранирована металлическим свинцом, а скорость выделения водорода на свинце очень мала, то в целом скорость коррозии (окисления) марганца в кислоте при добавлении раствора нитрата свинца резко уменьшается.
Дата добавления: 2015-07-11; просмотров: 432 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Окрашивание анодно-оксидных пленок на алюминии проводят для придания изделию декоративных свойств. | | | Абстракт |