
Читайте также:
|
ТЕМА 1 (задачи №№ 1...20)
Для атомов элементов, порядковые номера которых соответствуют номеру Ващей задачи,
| Номера задач | Порядковые номера Z | Номера задач | Порядковые номера Z | ||
| Тема 1 | Тема 2 | Тема 1 | Тема 2 | ||
| а) 21; б) 16 | а) 24; б) 4 | ||||
| а) 24; б) 31 | а) 25; б) 20 | ||||
| а) 30; б) 6 | а) 41; б) 38 | ||||
| а) 39; б) 15 | а) 42; б) 50 | ||||
| а) 40; б) 35 | а) 73; б) 17 | ||||
| а) 48; б) 14 | а) 74; б) 82 | ||||
| а) 57; б) 33 | а) 43; б) 81 | ||||
| а) 72; б) 53 | а) 75; б) 83 | ||||
| а) 89; б) 34 | а) 80; б) 32 | ||||
| а) 23; б) 84 | а) 72; б) 49 |
найдите число протонов и число нейтронов (для изотопа, массовое число которого A ближе всего к атомной массе элемента). Запишите электронные формулы атомов в основных состояниях. Определите электронные семейства, к которым принадлежат данные элементы. Приведите электронно-графические формулы атомов в основных и в возбужденных состояниях и определите валентное состояние в каждом из них.
Решение.
массовое число A = округленной до целого числа атомной массе элемента (см. Периодическую систему элементов, с.1).
ЧИСЛО ПРОТОНОВ = Z;ЧИСЛО нейтРОНОВ= A – Z.
ЭЛЕКТРОННАЯ ФОРМУЛА В ОСНОВНОМ СОСТОЯНИИ – см. КРАТКИЕ ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ В ОСНОВНОМ СОСТОЯНИИ (с.9-12).
электронное семейство – см. там же.
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА В ОСНОВНОМ СОСТОЯНИИ – см. там же.
ЭЛЕКТРОННО-ГРАФИЧЕСКАЯ ФОРМУЛА В Возбужденном состоянии – см. электронно-графические формулы атомов s -, p - и d -элементов в возбужденных состояниях (с.12-13)
Валентное состояние – определяется числом неспаренных электронов в атоме, т.е. обшим числом  в электронно-графической формуле.
в электронно-графической формуле.
Краткие электронные и электронно-графические формулы атомов в основном состоянии (подчеркнуты обозначения валентных электронов)
| Символ элемента | Электрон-ное семейство | Краткая электронная формула атома в основном состоянии | ЭГФ атома в основном состоянии |
| Ac | f | [Rn] 6 d 17 s 2 | 
|
| Ag | d | [Kr] 4 d 105 s 1 | 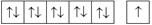
|
| Al | р | [Ne] 3 s 23 р 1 | 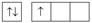
|
| Am | f | [Rn] 5 f 77 s 2 | 
|
| Ar | р | [Ne] 3 s 23 р 6 | 
|
| As | р | [Ar]3 d 10 4 s 24 р 3 | 
|
| At | р | [Xe]4 f 145 d 10 6 s 26 р 5 | 
|
| Au | р | [Xe]4 f 14 5 d 106 s 1 | 
|
| B | p | [He] 2 s 22 р 1 | 
|
| Ba | s | [Xe] 6 s 2 | 
|
| Be | s | [He] 2s2 | 
|
| Bh | d | [Rn]5 f 14 6 d 57 s 2 | 
|
| Bi | p | [Xe]4 f 145 d 10 6 s 26 р 3 | 
|
| Bk | f | [Rn] 5 f 86 d 17 s 2 | 
|
| Br | p | [Ar]3 d 10 4 s 24 р 5 | 
|
| C | p | [He] 2 s 22 р 2 | 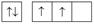
|
| Ca | s | [Ar] 4 s 2 | 
|
| Cd | d | [Kr]4 d 10 5 s 2 | 
|
| Ce | f | [Xe] 4 f 15 d 16 s 2 | 
|
| Cf | f | [Rn] 5 f 107 s 2 | 
|
| Cl | p | [Ne] 3 s 23 р 5 | 
|
| Cm | f | [Rn] 5 f 76 d 17 s 2 | 
|
| Co | d | [Ar] 3 d 74 s 2 | 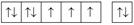
|
| Cr | d | [Ar] 3 d 54 s 1 | 
|
| Cs | s | [Xe] 6 s 1 | 
|
| Cu | d | [Ar] 3 d 104 s 1 | 
|
| Db | d | [Rn]5 f 14 6 d 37 s 2 | 
|
| Ds | d | [Rn]5 f 14 6 d 87 s 2 | 
|
| Dy | f | [Xe] 4 f 106 s 2 | 
|
| Er | f | [Xe] 4 f 126 s 2 | 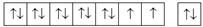
|
| Es | f | [Rn] 5 f 117 s 2 | 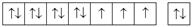
|
| Eu | f | [Xe] 4 f 76 s 2 | 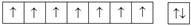
|
| F | p | [He] 2 s 22 р 5 | 
|
| Fe | d | [Ar] 3 d 64 s 2 | 
|
| Fm | f | [Rn] 5 f 127 s 2 | 
|
| Fr | s | [Rn] 7 s 1 | 
|
| Ga | p | [Ar]3 d 10 4 s 24 р 1 | 
|
| Gd | f | [Xe] 4 f 75 d 16 s 2 | 
|
| Ge | p | [Ar]3 d 10 4 s 24 р 2 | 
|
| H | s | 1 s 1 | 
|
| He | s | 1 s 2 | 
|
| Hf | d | [Xe]4 f 14 5 d 26 s 2 | 
|
| Hg | d | [Xe]4 f 145 d 10 6 s 2 | 
|
| Ho | f | [Xe] 4 f 116 s 2 | 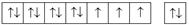
|
| Hs | d | [Rn]5 f 14 6 d 67 s 2 | 
|
| I | p | [Kr]4 d 10 5 s 25 р 5 | 
|
| In | p | [Kr]4 d 10 5 s 25 р 1 | 
|
| Ir | d | [Xe]4 f 14 5 d 76 s 2 | 
|
| K | s | [Ar] 4 s 1 | 
|
| Kr | p | [Ar]3 d 10 4 s 24 р 6 | 
|
| La | f | [Xe] 5 d 16 s 2 | 
|
| Li | s | [He] 2s1 | 
|
| Lr | d | [Rn]5 f 14 6 d 17 s 2 | 
|
| Lu | d | [Xe]4 f 14 5 d 16 s 2 | 
|
| Md | f | [Rn] 5 f 137 s 2 | 
|
| Mg | s | [Ne] 3 s 2 | 
|
| Mn | d | [Ar] 3 d 54 s 2 | 
|
| Mo | d | [Kr] 4 d 55 s 1 | 
|
| Mt | d | [Rn]5 f 14 6 d 77 s 2 | 
|
| N | p | [He] 2 s 22 р 3 | 
|
| Na | s | [Ne] 3 s 1 | 
|
| Nb | d | [Kr] 4 d 45 s 1 | 
|
| Nd | f | [Xe] 4 f 46 s 2 | 
|
| Ne | p | [He] 2 s 22 р 6 | 
|
| Ni | d | [Ar] 3 d 84 s 2 | 
|
| No | f | [Rn] 5 f 147 s 2 | 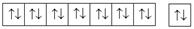
|
| Nр | f | [Rn] 5 f 46 d 17 s 2 | 
|
| O | p | [He] 2 s 22 р 4 | 
|
| Os | d | [Xe]4 f 14 5 d 66 s 2 | 
|
| Р | p | [Ne] 3 s 23 р 3 | 
|
| Рa | f | [Rn] 5 f 26 d 17 s 2 | 
|
| Рb | p | [Xe]4 f 145 d 10 6 s 26 р 2 | 
|
| Рd | d | [Kr] 4 d 105 s 0 | 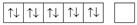
|
| Рm | f | [Xe] 4 f 56 s 2 | 
|
| Рo | p | [Xe]4 f 145 d 10 6 s 26 р 4 | 
|
| Рr | f | [Xe] 4 f 36 s 2 | 
|
| Рt | d | [Xe]4 f 14 5 d 96 s 1 | 
|
| Рu | f | [Rn] 5 f 67 s 2 | 
|
| Ra | s | [Rn] 7 s 2 | 
|
| Rb | s | [Kr] 5 s 1 | 
|
| Re | d | [Xe]4 f 14 5 d 56 s 2 | 
|
| Rf | d | [Rn]5 f 14 6 d 27 s 2 | 
|
| Rg | d | [Rn]5 f 14 6 d 107 s 1 | 
|
| Rh | d | [Kr] 4 d 85 s 1 | 
|
| Rn | p | [Xe]4 f 145 d 10 6 s 26 р 6 | 
|
| Ru | d | [Kr] 4 d 75 s 1 | 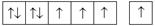
|
| S | p | [Ne] 3 s 23 р 4 | 
|
| Sb | p | [Kr]4 d 10 5 s 25 р 3 | 
|
| Sc | d | [Ar] 3 d 14 s 2 | 
|
| Se | p | [Ar]3 d 10 4 s 24 р 4 | 
|
| Sg | d | [Rn]5 f 14 6 d 47 s 2 | 
|
| Si | p | [Ne] 3 s 23 р 2 | 
|
| Sm | f | [Xe] 4 f 66 s 2 | 
|
| Sn | p | [Kr]4 d 10 5 s 25 р 2 | 
|
| Sr | s | [Kr] 5 s 2 | 
|
| Ta | d | [Xe]4 f 14 5 d 36 s 2 | 
|
| Tb | f | [Xe] 4 f 96 s 2 | 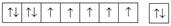
|
| Tc | d | [Kr] 4 d 55 s 2 | 
|
| Te | p | [Kr]4 d 10 5 s 25 р 4 | 
|
| Th | f | [Rn] 6 d 27 s 2 | 
|
| Ti | d | [Ar] 3 d 24 s 2 | 
|
| Tl | p | [Xe]4 f 145 d 10 6 s 26 р 1 | 
|
| Tm | f | [Xe] 4 f 136 s 2 | 
|
| U | f | [Rn] 5 f 36 d 17 s 2 | 
|
| V | d | [Ar] 3 d 34 s 2 | 
|
| W | d | [Xe]4 f 14 5 d 46 s 2 | 
|
| Xe | p | [Kr]4 d 10 5 s 25 р 6 | 
|
| Y | d | [Kr] 4 d 15 s 2 | 
|
| Yb | f | [Xe] 4 f 146 s 2 | 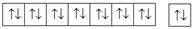
|
| Zn | d | [Ar]3 d 10 4 s 2 | 
|
| Zr | d | [Kr] 4 d 25 s 2 | 
|
электронно-графические формулы атомов s -, p - и d -элементов в возбужденных состояниях
| ЭГФ атомов в основном состоянии | ЭГФ атомов в возбужденных состояниях | ||

| 
| (Э ≠ He) | |

| 
| ||
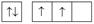
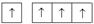
| 
| ||

| 
| (Э ≠ N) | |

| 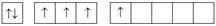 и и  (Э ≠ O)
(Э ≠ O)
| ||

|  , ,  и и
 (Э ≠ F) (Э ≠ F)
| ||

| 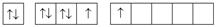 , ,  , ,
 и и  (Э ≠ Ne)
(Э ≠ Ne)
| ||

| 
| ||

| 
| ||

| 
| ||

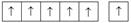
| 
| ||

| 
| ||
 , ,

|  и и 
| ||
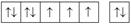 , ,

|  , ,  и и

| ||
 , ,

|  , ,  и и

| ||

|  , ,  , ,
 и и 
| ||

|  , ,  и и

| ||
Тема 2. (задачи №№ 21...40)
На основании положения химических элементов, порядковые номера которых в периодической системе элементов Д.И. Менделеева (см. с.1) соответствуют номеру Вашей задачи (см. ТЕМА 1.), охаpактеpизуйте свойства этих элементов, ответив на следующие вопросы:
1. Являются ли эти элементы металлами или неметаллами?
2. Простые вещества этих элементов обычно выступают в pоли окислителей, проявляют окислительно-восстановительную двойственность, или являются только восстановителями?
3. Чему равны высшие и низшие степени окисления атомов этих элементов?
4. Каковы формулы высших оксидов и гидроксидов этих элементов?
5. Какими кислотно-оснóвными свойствами обладают эти оксиды и гидроксиды? Напишите уравнения химических реакций, подтверждающих наличие указанных свойств.
6. Образуют ли данные элементы газообразные водородные соединения? Если да, то приведите их формулы.
Решение.
1. Перечень неметаллов: Ar, As, At, B, Br, C, Cl, F, H, He, I, Kr, N, Ne, O, P, Rn, S, Se, Si, Te. Xe. Все остальные элементы являются металлами.
2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ:
а) элементы, простые вещества которых обычно выступают в pоли окислителей – Br, Cl, F, O;
б) элементы, простые вещества которых проявляют окислительно-восстановительную двойственность – B, элементы IVА–VIIА-групп периодической системы элементов Д.И. Менделеева (см. с.1), не указанные в п.а);
в) Элементы, простые вещества которых являются только восстановителями – все остальные.
3. Высшая степень окисления, как правило, равна номеру группы элемента в периодической системе элементов Д.И. Менделеева (см. с.1) со знаком «+» (у H она равна +1).
Низшая степень окисления у элементов:
а) IVA–VIIA-групп периодической системы элементов Д.И. Менделеева (см. с.1) равна разности между номером группы элемента и числом 8 (у H она равна –1);
б) остальных групп равна 0.
4. ФОРМУЛЫ ВЫСШИХ ОКСИДОВ И ГИДРОКСИДОВ
(Э – химический знак элемента)
| номер группы | I | II | III | IV | V | VI | VII | |
| формулы высших оксидов | Э2O | ЭО | Э2O3 | ЭO2 | Э2O5 | ЭO3 | Э2O7 | |
| формулы высших гидроксидов | ЭOH | Э(OH)2 | Э(OH)3 | H2ЭO3 (Э = C, Si) | Э(OH)4 (Э ≠ C, Si) | HЭO3 | H2ЭO4 | HЭO4 |
5. Кислотно-оснóвные свойства. Элементы, высшие оксиды и гидроксиды которых обладают:
а) оснóвными свойствами – IA-группа, IIA-группа (кроме Be), Ac, Hg, La, Y;
б) кислотными свойствами – B, C, Si, V–VIII группы;
в) амфотерными свойствами – все остальные.
6. УРАВНЕНИЯ РЕАКЦИЙ, ПОДТВЕРЖДАЮЩИХ Кислотно-оснóвные свойства ( Э – химический знак элемента)
I. Оснóвные
Э2O z + 2 z HCl = 2 ЭCl z + z H2O, или ЗO z + 2 z HCl = ЭCl2 z + z H2O;
Э(OH) x + x HCl = ЭCl x + x H2O;
II. Кислотные
Э2O z + 2 NaOH = 2 NaЭO( z+ 1)/2 + H2O, или ЭO z + 2NaOH = Na2ЭO z+ 1 +H2O;
HЭO y + NaOH = NaЭO y + H2O, или H2ЭO y + 2 NaOH = Na2ЭO y + 2 H2O;
III. Амфотерные
Э2O z + 2 z HCl = 2 ЭCl z + z H2O, или ЭO z + 2 z HCl = ЭCl2 z + z H2O;
Э2O z + 2 NaOH = 2 NaЭO( z+ 1)/2 + z H2O, или ЭO z + 2 NaOH = Na2ЭO z+ 1 + z H2O;
Э(OH) x + x HCl = ЭCl x + x H2O;
ЭOH+ NaOH = Na[Э(OH)2], или Э(OH)2+ 2 NaOH = Na2[Э(OH)4], или
Э(OH)3+ NaOH = Na[Э(OH)4], или Э(OH)4+ 2 NaOH = Na2[Э(OH)6].
7. Газообразные водородные соединения элементов
| Номер группы | IVA | VA | VIA | VIIA |
| Формулы водородных соединений | ЭН4 | ЭH3 | Н2Э | НЭ |
Остальные элементы не образуют газообразных водородных соединений.
ТЕМА 3 (задачи №№ 41...60)
Определите тип химической связи (ковалентная неполярная, ковалентная полярная или ионная) в веществах, соответствующих номеру Вашей задачи,
| Номер задачи | Формулы веществ | Номер задачи | Формулы веществ |
| CsF; O2 | KBr; Cl3N | ||
| CaBr2; CF4 | LiCl; N2 | ||
| SrBr2; BCl3 | SrF2; Br2 | ||
| CaO; GeH4 | BаF2; BeH2 | ||
| Li2O; AsCl3 | BaBr2; GeCl4 | ||
| KF; BeBr2 | CsBr; PBr3 | ||
| LiBr; H2Te | Li3N; SCl2 | ||
| CaF2; MgI2 | CsI; CI4 | ||
| NaBr;AsH3 | RbBr; S2 | ||
| CsCl; NF3 | KCl; PCl3 |
(необходимые для расчетов электроотрицательности ЭО приведены ниже). В случае ковалентной полярной или ионной связи укажите направление смещения электронов. В случае ковалентной (полярной или неполярной) связи постройте схемы перекрывания атомных орбиталей и определите геометрическую форму молекулы.
Электроотрицательности по полингу
| Элемент | As | B | Ba | Be | Br | C | Ca | Cl | Cs | F | Ge | H | I |
| ЭО | 2,18 | 2,04 | 0,89 | 1,57 | 2,96 | 2,55 | 1,00 | 3,16 | 0,79 | 3,98 | 2,01 | 2,2 | 2,66 |
| Элемент | K | Li | Mg | N | Na | O | P | Rb | S | Se | Si | Sr | Te |
| ЭО | 0,82 | 0,98 | 1,31 | 3,04 | 0,93 | 3,44 | 2,19 | 0,82 | 2,58 | 2,55 | 1,90 | 0,95 | 2,10 |
Решение.
1. Тип связи:
а) если ΔЭО ≥ 1,8, то связь является ионной,
б) если 0 < ΔЭО < 1,8, то связь является ковалентной полярной,
в) если ΔЭО = 0, то связь является ковалентной неполярной.
2. направление смещения электронов: от атомов с мéньшей ЭО к атомам с бóльшей ЭО.
3. схемы перекрывания атомных орбиталей – см. СТРОЕНИЕ ПРОСТЕЙШИХ МОЛЕКУЛ (с.16-17).
4. Геометрическая форма молекулы – см. там же.
СТРОЕНИЕ ПРОСТЕЙШИХ МОЛЕКУЛ
| Моле-кула | Элемент A | Элемент B | Схема перекрывания атомных орбиталей | Геометрическая форма |
| A2 | H, IA-группа | - | 
| линейная |
| A2 | VIIA-группа | - | 
| линейная |
| A2 | VIA-группа | - | 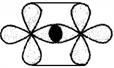
| линейная |
| A2 | VA-группа | - | 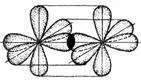
| линейная |
| AB | H | VIIA-группа |
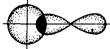
| линейная |
| A2B | H | VIA-группа |
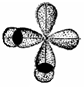
| угловая |
| AB2 | VIA-группа | VIIA-группа |
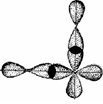
| угловая |
| AB2 | IIA-группа | H |

| линейная |
| AB2 | IIA-группа | VIIA-группа |

| линейная |
| AB3 | VA-группа | H |

| треугольно-пирамидальная |
| AB3 | VA-группа | VIIA-группа |
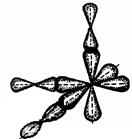
| треугольно-пирамидальная |
| A3B | VIIA-группа | VA-группа | ||
| AB3 | IIIA-группа | H |
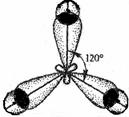
| плоско-треугольная |
| AB3 | IIIA-группа | VIIA-группа |
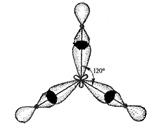
| плоско-треугольная |
| AB4 | IVA-группа | H |
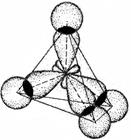
| тетраэдрическая |
| AB4 | IVA-группа | VIIA-группа | 
| тетраэдрическая |
ТЕМА 4 (задачи №№ 61...80)
Вычислите величины 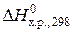 ,
, 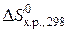 и
и 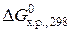 для реакции, уравнение которой соответствует номеру Вашей задачи (необходимые для расчетов данные см. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ на с.19)).
для реакции, уравнение которой соответствует номеру Вашей задачи (необходимые для расчетов данные см. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ на с.19)).
| Номера задач | Уравнения реакций | |
| Тема 1 | Тема 1 | |
| CH3CHO(г) ⇄ CH4(г) + CO(г) | ||
| 2NO(г) + 2H2(г) ⇄ N2(г) + 2H2O(г) | ||
| 2NO(г) + O2(г) ⇄ 2NO2(г) | ||
| C2Cl4(г) + Cl2(г) ⇄ C2Cl6(г) | ||
| 4H2(г) + 2NO2(г) ⇄ 4H2O(г) + N2(г) | ||
| 2NO(г) + Cl2(г) ⇄ 2NOCl(г) | ||
| 2NO(г) + H2(г) ⇄ N2O(г) + H2O(г) | ||
| CO(г) + Cl2(г) ⇄ CCl2O(г) | ||
| H2(г) + Br2(г) ⇄ 2HBr(г) | ||
| H2O2(г) + H2(г) ⇄ 2H2O(г) | ||
| SO2(г) + 2H2(г) ⇄ S(г) + 2H2O(г) | ||
| H2(г) + I2(г) ⇄ 2HI(г) | ||
| CH4(г) + 2S2(г) ⇄ CS2(г) + 2H2S(г) | ||
| 2NO(г) + Br2(г) ⇄ 2NOBr(г) | ||
| 2N2O5(г) ⇄ 4NO2(г) + O2(г) | ||
| HCHO(г) ⇄ H2(г) + CO(г) | ||
| CO(г) + NO2(г) ⇄ CO2(г) + NO(г) | ||
| 2O3(г) ⇄ 3O2(г) | ||
| CO(г) + H2O(г) ⇄ CO2(г) + H2(г) | ||
| N2(г) + O2(г) ⇄ 2NO(г) |
Объясните знак энтальпии реакции, величину и знак энтропии реакции. Возможна ли данная реакция при стандартных условиях и 298 K?
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ
| Формула вещества | 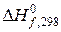 ,
кДж/моль ,
кДж/моль
| 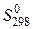 , Дж/(K·моль) , Дж/(K·моль)
| Формула вещества | 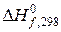 ,
кДж/моль ,
кДж/моль
| 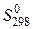 , Дж/(K·моль) , Дж/(K·моль)
|
| Br2(г) | H2O2(г) | –136 | |||
| C2Cl4(г) | H2S(г) | –21 | |||
| C2Cl6(г) | I2(г) | ||||
| CCl2O(г) | –220 | N2(г) | |||
| CH3CHO(г) | –166 | N2O(г) | |||
| CH4(г) | –75 | NO(г) | |||
| CO(г) | –111 | NO2(г) | |||
| CO2(г) | –394 | N2O5(г) | |||
| CS2(г) | NOBr(г) | ||||
| Cl2(г) | NOCl(г) | ||||
| H2(г) | O2(г) | ||||
| HBr(г) | –36 | O3(г) | |||
| HCHO(г) | –116 | S(г) | |||
| HI(г) | S2(г) | ||||
| H2O(г) | –242 |
Решение.
Для реакции, уравнение которой
a A(г) + b B(г) ⇄ d D(г) + e E(г), (*)
где a, b, d, e – коэффициенты; A, B, D, E – формулы участников реакции;
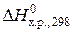 = d·
= d· 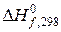 (D) + e·
(D) + e· 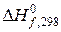 (E) – (a·
(E) – (a· 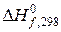 (A) + b·
(A) + b· 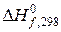 (B)),
(B)),
где 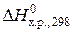 – стандартная энтальпия реакции при 298 K, кДж/моль;
– стандартная энтальпия реакции при 298 K, кДж/моль; 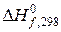 (...) – стандартные энтальпии образования участников реакции при 298 K, кДж/моль (см. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ на с.19).
(...) – стандартные энтальпии образования участников реакции при 298 K, кДж/моль (см. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ на с.19).
Объяснение знака энтальпии реакции. Если 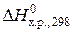 > 0, то в ходе реакции теплота поглощается, реакция является эндотермической, если
> 0, то в ходе реакции теплота поглощается, реакция является эндотермической, если 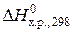 < 0, то в ходе реакции теплота выделяется, реакция является экзотермической.
< 0, то в ходе реакции теплота выделяется, реакция является экзотермической.
Для реакции, уравнение которой (*)
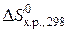 = d ·
= d · 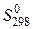 (D) + e ·
(D) + e · 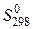 (E) – (a ·
(E) – (a · 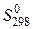 (A) + b ·
(A) + b · 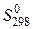 (B)),
(B)),
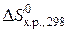 – стандартная энтропия реакции при 298 K, Дж/(K·моль);
– стандартная энтропия реакции при 298 K, Дж/(K·моль); 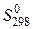 (...) – стандартные энтропии участников реакции при 298 K, Дж/(K·моль) (см. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ на с.19).
(...) – стандартные энтропии участников реакции при 298 K, Дж/(K·моль) (см. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ВЕЩЕСТВ на с.19).
Объясннение величины и знака энтропии реакции. Основной вклад в нее вносит изменение общего числа молекул газов в ходе реакции. Чтобы найти это изменение, надо сравнить между собой суммы коэффициентов, стоящих перед формулами газов, в обеих частях уравнения. Если (d + e) > (a + b), т.е. в ходе реакции общее число молекул газов убывает, то 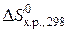 заметно отрицательна, если (d + e) < (a + b), т.е. в ходе реакции общее число молекул газов возрастает, то
заметно отрицательна, если (d + e) < (a + b), т.е. в ходе реакции общее число молекул газов возрастает, то 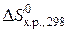 заметно положительна. Если же (d + e) = (a + b), т.е. в ходе реакции общее число молекул газов не изменяется, то
заметно положительна. Если же (d + e) = (a + b), т.е. в ходе реакции общее число молекул газов не изменяется, то 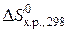 ≈ 0.
≈ 0.
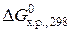 =
= 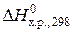 – T ·
– T · 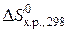 ,
,
где 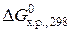 – стандартная энергия Гиббса реакции при 298 K, кДж/моль; T – температура, К;
– стандартная энергия Гиббса реакции при 298 K, кДж/моль; T – температура, К; 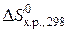 – стандартная энтропия реакции при 298 K, кДж/(K·моль).
– стандартная энтропия реакции при 298 K, кДж/(K·моль).
Если 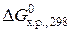 > 0, то при стандартных условиях и 298 K реакция невозможна, если
> 0, то при стандартных условиях и 298 K реакция невозможна, если 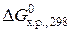 < 0, то возможна.
< 0, то возможна.
ТЕМА 5 (задачи №№ 81...100)
Для реакции, уравнение которой соответствует номеру Вашей задачи (см. тему 4):
- составьте кинетическое уравнение;
- вычислите, как и во сколько раз изменится скорость реакции при заданных изменениях: а) температуры, б) общего давления (при изменении объема системы), в) концентраций реагентов;
- составьте выражение для константы равновесия;
- укажите, как необходимо изменить внешние параметры (температуру, общее давление, концентрации реагентов), чтобы сместить равновесие вправо. Все необходимые для решения данные приведены ниже [g – температурный коэффициент, в трех последних столбцах указано, во сколько раз увеличили концентрацию первого реагента (столбец 7), второго реагента (столбец 8) и общее давление в системе (столбец 9)].
| Hомеp задачи | Порядок по 1-му реагенту x 1 | Порядок по 2-му реагенту x 2 | g | T 1, K | T 2, K | 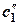 / /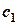
| 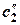 / /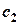
| p ''/ p |
| ― | 3,0 | ― | ||||||
| 2,5 | ||||||||
| 2,1 | ||||||||
| 1,5 | 2,7 | |||||||
| 3,2 | ||||||||
| 2,0 | ||||||||
| 3,0 | ||||||||
| 1,5 | 2,1 | |||||||
| 0,5 | 2,6 | |||||||
| 2,5 | ||||||||
| Hомеp задачи | Порядок по 1-му реагенту x 1 | Порядок по 2-му реагенту x 2 | g | T 1, K | T 2, K | 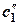 / /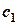
| 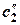 / /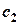
| p ''/ p |
| 3,3 | ||||||||
| 3,7 | ||||||||
| 2,7 | ||||||||
| 3,4 | ||||||||
| ― | 3,5 | ― | ||||||
| ― | 2,8 | ― | ||||||
| 3,3 | ||||||||
| ― | 3,2 | ― | ||||||
| 2,1 | ||||||||
| 3,1 |
Решение.
Для реакции, уравнение которой (*),
v = k ·{ с (A)} 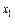 ·{ с (B)}
·{ с (B)} 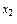 ,
,
где v – скорость реакции; k – константа скорости; с (A) и с (B) – концентрации реагентов A и B соответственно; x 1 и x 2
Дата добавления: 2015-07-11; просмотров: 196 | Нарушение авторских прав