
|
Читайте также: |
Чтобы получить согласие с результатами наблюдений, Бор предположил, что электрон в атоме водорода движется только по тем круговым орбитам, для которых его момент импульса
М = n 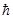 , n = 1, 2, 3,..., где n - квантовые числа
, n = 1, 2, 3,..., где n - квантовые числа
С помощью этого правила квантования можно найти радиусы круговых стационарных орбит водородоподобных систем (Н, Не+, Li++...) и соответствующие им энергии. Пусть заряд ядра водородоподобной системы равен Ze. Масса ядра значительно больше массы электрона, поэтому ядро при движении электрона можно считать неподвижным. Следуя Бору, будем предполагать, что электрон движется вокруг ядра по окружности радиуса r. Согласно 2-му закону Ньютона
 ,
,  , m - масса электрона. Отсюда кинетическая энергия электрона
, m - масса электрона. Отсюда кинетическая энергия электрона

и полная энергия электрона в кулоновском поле ядра
E = Т + U = 
Согласно правилу квантования, rmv = n 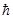 , откуда
, откуда
v = n 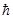 / rm
/ rm
После подстановки полученной скорости в
 получаем для радиуса n -й стационарной орбиты:
получаем для радиуса n -й стационарной орбиты:
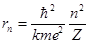
Радиус первой стационарной орбиты электрона в атоме водорода (n = 1, Z = 1) равен
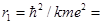 0,529×10-10 м
0,529×10-10 м
Его называют боровским радиусом.
Подставляя выражение для rn в формулу для энергии электрона, получаем выражение для энергии Еn электрона на n -й стационарной орбите:
E = Т + U = 
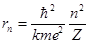

Эта формула описывает уровни энергии стационарных состояний электрона в водородоподобной системе. Для атома водорода схема энергетических уровней, соответствующих последней формуле представлена на рисунке. При n ® ¥ уровни энергии сгущаются к своему предельному значению Е ¥ = 0.
Состояние атома с наименьшей энергией (n = 1) называют основным. Для атома водорода основному состоянию соответствует энергия E 1 = - 13,53 эВ. Эта энергия (по модулю) является энергией связи электрона в основном состоянии: Есв = Е 1. Именно такую энергию надо сообщить электрону в основном состоянии (n = 1), чтобы удалить его из атома водорода. По этой причине ее называют еще и энергией ионизации:
Еион = Есв = 13,6 эВ.
Это значение из боровской теории находится в хорошем согласии с результатами эксперимента.
Спектральные серии водородоподобных систем
Используя второй постулат Бора (h n = Е 2 - Е 1) и формулу для энергии электрона на n -ой стационарной орбите

получаем формулу для энергии фотона, излучаемого или поглощаемого при переходе электрона из одного стационарного состояния в другое

Отсюда частота фотона

Таким образом, мы пришли к обобщенной формуле Бальмера  , установив при этом, от каких величин зависит постоянная Ридберга:
, установив при этом, от каких величин зависит постоянная Ридберга:

Полученная формула хорошо согласуется с экспериментом.
Приведенная на рисунке система энергетических уровней помогает наглядно представить спектральные серии Лаймана, Бальмера и др. как группы переходов между соответствующими уровнями. Эти переходы изображены на рисунке вертикальными стрелками.

Недостатки теории Бора
Теория Бора явилась крупным шагом в развитии теории атома, в понимании новых квантовых закономерностей, с которыми столкнулась физика при изучении явлений микромира. Эта теория отчетливо показала неприменимость законов классической физики для описания внутриатомных явлений.
Теория Бора стимулировала постановку многих экспериментов, принесших важные результаты.
Однако двух постулатов Бора недостаточно для построения полной теории. Они должны быть дополнены правилами квантования. Эти правила, достаточно искусственно введенные Бором для одноэлектронного атома, радикально проблемы не решили. Их не удалось распространить даже на простейший после водорода атом гелия, содержащий два электрона. Кроме того, теория Бора позволяла вычислить только частоты спектральных линий, но не их интенсивность.
Основной же, принципиальный недостаток теории Бора - это ее непоследовательность: она не была ни последовательно классической, ни последовательно квантовой. Эта теория принимала существование стационарных состояний атома, что совершенно непонятно с точки зрения классической физики. И вместе с тем к движению электронов в стационарных состояниях она применяла законы классической механики, хотя и считала неприменимой классическую электродинамику (поскольку нет излучения).
Итак, планетарную модель атома нельзя считать серьезной теорией. Она просто неверна. Тот факт, что эта модель приводит к очень хорошим результатам в случае атома водорода (при расчете некоторых величин), по существу случайный. Этот успех явился мощным толчком к развитию квантовой теории атома. Сам Бор рассматривал свою теорию как промежуточный этап в поисках верной теории. Такой последовательной теорией явилась квантовая физика.
Дата добавления: 2015-07-11; просмотров: 173 | Нарушение авторских прав