
Читайте также:
|
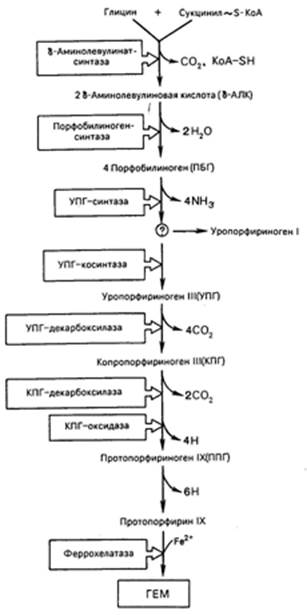
К настоящему времени почти полностью выяснены основные пути образования порфиринов и протопорфиринов, являющихся непосредственными предшественниками гема и хлорофилла. Благодаря исследованиям Д. Шемина и др. выяснены основные пути синтеза гема. С помощью меченых предшественников было показано, что в синтезе гема в бесклеточных экстрактах эритроцитов птиц специфическое участие принимают глицин, уксусная и янтарная кислоты. Источником всех 4 атомов и 8 атомов углерода тетрапиррольного кольца оказался глицин, а источником остальных 26 из 34 атомов углерода – янтарная кислота (сукцинат), точнее ее производное сукцинил-КоА. Последовательность химических реакций синтеза тетрапирролов в организме животных можно условно разделить на несколько стадий.
На I стадии, протекающей в 2 этапа, сукцинил-КоА взаимодействует с глицином с образованием d-аминолевулиновой кислоты (d-АЛК).
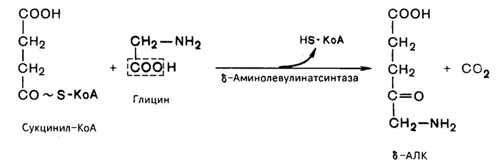 |
Эту стадию катализирует специфический пиридоксальфосфатзависимый фермент 8-аминолевулинатсинтаза – ключевой, аллостерический фермент синтеза тетрапирролов.
Впервые эта синтаза была обнаружена в эндоплазматической сети клеток печени. Фермент индуцируется стероидами и другими факторами и ингибируется по типу обратной связи конечным продуктом биосинтеза – гемом.
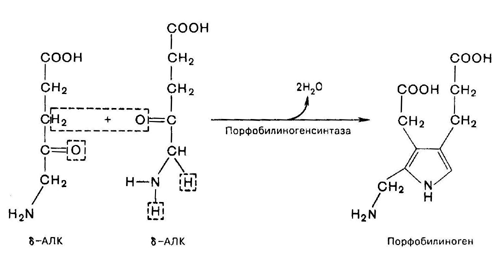 |
 Фермент, катализирующий эту стадию, - порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают, что механизм этой сложной реакции дегидратации включает образование кетиминной связи (шиффово основание) между кетогруппой одной молекулы d-аминолевулиновой кислоты и d-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетрапиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником тема. Некоторые этапы сложного пути синтеза окончательно не установлены.
Фермент, катализирующий эту стадию, - порфобилиногенсинтаза также является регуляторным ферментом, подвергаясь ингибированию конечными продуктами синтеза. Предполагают, что механизм этой сложной реакции дегидратации включает образование кетиминной связи (шиффово основание) между кетогруппой одной молекулы d-аминолевулиновой кислоты и d-аминогруппой лизина молекулы фермента. В следующей многоступенчатой стадии, катализируемой соответствующими ферментами, из 4 монопиррольных молекул порфобилиногена синтезируется тетрапиррольный комплекс протопорфирин IX, являющийся непосредственным предшественником тема. Некоторые этапы сложного пути синтеза окончательно не установлены.
В заключительной стадии протопорфирин IX присоединяет молекулу железа при участии феррохелатазы (гемсинтазы), и образуется гем. Последний используется для биосинтеза всех гемсодержащих хромопротеинов.
Источником железа для этой реакции является ферритин, который считается резервным гемопротеином, откладывающимся в клетках костного мозга, печени и селезенки.
Имеются указания, что, помимо железа, в синтезе тема участвуют некоторые кофакторы, в частности витамин В12, ионы меди, хотя конкретная их роль не раскрыта.
Таким образом, весь путь синтеза тема может быть представлен в виде схемы, в которой даны полные и сокращенные обозначения промежуточных метаболитов и ферментов.
Распад гемоглобина в тканях (образование желчных пигментов)
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе оба процесса могут происходить и в клетках других органов. Распад гемоглобина в печени начинается с разрыва a-метиновой связи между I и II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей оксидазой и приводит к образованию зеленого пигмента вердоглобина (холеглобина):
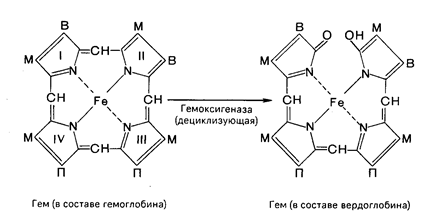
В приведенных структурных формулах здесь и далее в желчных пигментах М-метильная СН3-группа, В - (—СН=СН2)-винильная группа и П-(—СН2—СН2—СООН) – остаток пропионовой кислоты.
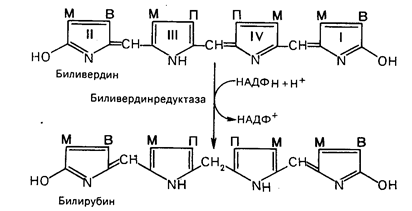 |
Основное место образования билирубина – печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метиновых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь. Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха.
В крови взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л. Около 75% этого количества приходится на долю непрямого билирубина. Повышение его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой билирубин, поступая с током крови в печень, подвергается обезвреживанию путем связывания с глюкуроновой кислотой. В этом процессе принимают участие особый фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка глюкуроновой кислоты с образованием сравнительно индифферентного комплекса – билирубин-диглюкуронида, хорошо растворимго в воде и дающего прямую реакцию с диазореактивом. В желчи всегда присутствует прямой билирубин. В крови количество прямого и непрямо билирубина, а также соотношение между ними резко меняются при поражениях печени, селезенки, костного мозга, болезнях крови и т.д., поэтому определение содержания обеих форм билирубина в крови имеет существенное значение при дифференциальной диагностике различных форм желтухи. При желчнокаменной болезни в составе желчных камней наряду с основным их компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде билирубината кальция, участвующего в формировании камней.
Дальнейшая судьба желчных пигментов, точнее билирубина, связана с их превращениями в кишечнике под действием бактерий. Сначала глюкуроновая кислота отщепляется от комплекса с билирубином и освободившийся билирубин подвергается восстановлению в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет около 300 мг стеркобилиногена. Последний легко окисляется под действием света и воздуха в стеркобилин. Механизм бактериальных превращений билирубиза до стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными продуктами восстановления являются последовательно мезобилирубин и мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена поступает через воротную вену в печень, где подвергается разрушению с образованием моно- и дипиррольных соединений. Кроме того, очень небольшая часть стеркобилиногена после всасывания через систему геморроидальных вен попадает в большой круг кровообращения, минуя печень, и в таком виде выводится с мочей. Суточное содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно стеркобилиноген является нормальной органической составной частью мочи. Если с мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена), то это является свидетельством недостаточности функции печени, например, при печеночной или гемолитической желтухе, когда печень частично теряет способность извлекать этот пигмент из крови воротной вены. Химически уробилиноген (мезобилиноген) неидентичен стеркобилиногену (уробилиногену) мочи. Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и биливердина является свидетельством полного прекращения поступлении желчи в кишечник. Такое состояние часто наблюдается при закупорке протока желчного пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная болезнь, раковые поражения поджелудочной железы и др.).
Список использованной литературы
1. Конспект лекций.
2. Березов Т.Т., Коровкин Б.Ф., Биологическая химия, М. Медицина, 1998, стр. 503-508.
3. Николаев А.Я., Биологическая химия, М. Высшая школа, 1989.
Дата добавления: 2015-07-10; просмотров: 173 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Синопсис пилотной серии | | | Синтез гема |