
Читайте также:
|
Рассмотрим выполнение задания 5 для реакции:
H2 + 2AgCl = 2Ag + 2HCl,
для которой 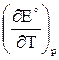 = – 6,45∙10-4 В/К.
= – 6,45∙10-4 В/К.
1) Для составления формулы электрохимической цепи необходимо подобрать две полуреакции, из которых методом алгебраического суммирования можно получить вышеприведенное уравнение.
2×½ AgCl + e–  Ag + Cl–,
Ag + Cl–,
–
1×½ 2H+ + 2e–  H2(г),
H2(г),
––––––––––––––––––––––––
2AgCl + H2  2Ag + 2HCl
2Ag + 2HCl
Составим электрохимическую цепь, в которой протекает данная реакция:
CuôPtôH2ôHClôAgClôAgôCu
2) Найдем термодинамические характеристики указанной реакции.
Изменение энтропии в ходе электрохимической реакции определим по уравнению (3.6):
DrS° = 2×96485 Кл/моль×(-6,45×10-4 В/К) = -124,40 Дж/(моль×К).
Рассчитаем E° по определению (3.1):
E° = j°прав – j°лев = 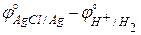 = 0,2222 – 0,0000 =
= 0,2222 – 0,0000 =
= 0,2222 В.
Вычислим DrG°, DrH° и максимальную полезную работу W¢max, применяя формулы (3.4), (3.8) и (3.9) соответственно.
DrG° = –2×96485 Кл/моль×0,2222 В = –42878 Дж/моль;
DrH° = –42878 + 298,15×(–124,40) = –79968 Дж/моль.
Для обратимо работающей электрохимической цепи:
W¢max =  = –(DrG)p,T = z×F×E = 42878 Дж/моль.
= –(DrG)p,T = z×F×E = 42878 Дж/моль.
3) Тепловой эффект электрохимической реакции определяем согласно второму началу термодинамики (3.7):
Qp = T×DrS° = 298,15×(–124,40) = –37090 Дж/моль.
Поскольку Qp< 0 и 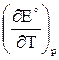 < 0, в адиабатических условиях электрохимическая цепь будет нагреваться, а в изотермических условиях — выделять теплоту в окружающую среду.
< 0, в адиабатических условиях электрохимическая цепь будет нагреваться, а в изотермических условиях — выделять теплоту в окружающую среду.
Обратите внимание на то, что Qp ¹ DrH, т.к. при протекании в электрохимической цепи реакции совершается электрическая работа.
4) Изменение внутренней энергии в ходе реакции найдем, используя первое начало термодинамики:
DrU° = Qp – Wрасш. – W¢ = T×DrS° – p×DV – (–DrG°)p,T = (T×DrS° + DrG°) –
– Dn×RT = DrH° – Dn×RT,
где Dn – изменение числа молей газообразных веществ в ходе реакции.
DrU° = –79968 – (–1)×8,314×298,15 = –77489 Дж/моль.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Вопросы к первому заданию
1. Можно ли для расчета среднего ионного моляльного коэффициента активности g± воспользоваться предельным законом Дебая–Хюккеля? В каком концентрационном диапазоне применим этот закон?
2. Почему при рассмотрении свойств реальных растворов вместо концентрации используют активность?
3. Какие методы используют для определения коэффициентов активности ионов?
Вопросы ко второму заданию
1. В чем различие между сильными и слабыми электролитами? Какая величина является количественной характеристикой силы электролита?
2. Изобразите графически зависимости удельной и молярной электрических проводимостей от концентрации электролитов. Объясните характер этих зависимостей.
3. Что называется константой кислотности? Чем это понятие отличается от константы диссоциации?
Вопросы к третьему заданию
1. С чем связано некоторое отличие значений произведения растворимости, рассчитанных разными способами? Какой метод расчета ПР точнее?
2. От каких факторов зависит ПР? Будет ли влиять внешнее давление на величину ПР?
3. Составьте формулу концентрационной электрохимической цепи, пригодной для определения константы автопротолиза воды, называемого ионным произведением воды. К какому типу относятся электроды, образующие такой элемент?
Вопросы к четвертому заданию
1. Может ли стандартная ЭДС электрохимической цепи быть отрицательной величиной?
2. Сформулируйте стандартные условия для реакции, протекающей в электрохимической цепи.
3. Почему состояние химического равновесия в электрохимической цепи характеризуют константой равновесия Ka, а не Kс? Как связаны эти величины?
Вопросы к пятому заданию
1. Каков физический смысл температурного коэффициента ЭДС?
2. Обладает ли теплота электрохимической реакции свойствами функции состояния? Дайте обоснованный ответ.
3.
Дата добавления: 2015-07-10; просмотров: 84 | Нарушение авторских прав