
|
Читайте также: |
АТОМНЫЕ СПЕКТРЫ - спектры поглощения и испускания свободных или слабо взаимодействующих атомов, возникающие при излучательных квантовых переходах между их уровнями энергии. А. с. наблюдаются для разреженных газов или паров и для плазмы. А. с. линейчатые, т. е. состоят из отд. спектральных линий, каждая из к-рых соответствует переходу между двумя электронными уровнями энергии атома 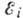 и
и 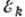 и характеризуется значением частоты
и характеризуется значением частоты 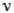 поглощаемого и испускаемого эл--магн. излучения; согласно условию частот Бора
поглощаемого и испускаемого эл--магн. излучения; согласно условию частот Бора 
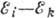 . Наряду с частотой, спектральная линия характеризуется волновым числом
. Наряду с частотой, спектральная линия характеризуется волновым числом 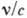 (с - скорость света) и длиной волны
(с - скорость света) и длиной волны 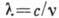 . Частоты спектральных линий выражают в с-1, волновые числа - в см-1, длины волн - в нм и мкм, а также в ангстремах (
. Частоты спектральных линий выражают в с-1, волновые числа - в см-1, длины волн - в нм и мкм, а также в ангстремах (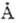 ). В спектроскопии волновые числа также обозначают буквой
). В спектроскопии волновые числа также обозначают буквой 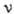 . Под А. с. в узком смысле слова понимают оптич. спектры атомов, т. е. спектры, лежащие в видимой, близкой ИK- (до неск. нм) и УФ-областях спектра и соответствующие переходам между уровнями внеш. электронов с типичными разностями энергий порядка неск.. Могут наблюдаться спектральные линии нейтрального атома и спектральные линии ионизованного атома. Линии спектра нейтрального атома принято отмечать цифрой I при символе хим. элемента, линии, принадлежащие положит. ионам,- римскими цифрами II, III,... соотв. кратности иона (напр., NaI, NaII, NaIII,... для Na, Na+, Na++,...), при этом часто говорят о 1-м, 2-м, 3-м... спектре данного элемента.
. Под А. с. в узком смысле слова понимают оптич. спектры атомов, т. е. спектры, лежащие в видимой, близкой ИK- (до неск. нм) и УФ-областях спектра и соответствующие переходам между уровнями внеш. электронов с типичными разностями энергий порядка неск.. Могут наблюдаться спектральные линии нейтрального атома и спектральные линии ионизованного атома. Линии спектра нейтрального атома принято отмечать цифрой I при символе хим. элемента, линии, принадлежащие положит. ионам,- римскими цифрами II, III,... соотв. кратности иона (напр., NaI, NaII, NaIII,... для Na, Na+, Na++,...), при этом часто говорят о 1-м, 2-м, 3-м... спектре данного элемента.
Наиб. простыми А. с. обладают атом водорода и водородоподобные ионы (спектры HI, HeII, LiIII,...), к-рые состоят из закономерно расположенных спектральных линий, образующих спектральные серии. Волновые числа для спектральных линий серии атома водорода и водородоподобных атомов определяются ф-лой
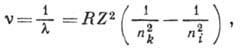
где nk и ni - гл. квантовые числа для нижнего и верхнего уровней энергии.Р - Ридберга постоянная, Z - ат. номер. При nk= 1, 2, 3, 4, 5,6 и ni = nk +l, nk +2,..., h для атома водорода (Z=1)получаются соотв. серии Лаймана, Бальмера, Пашена, Брэкета, Пфунда, Хамфри. Для каждой серии существует предел - граница ионизации, соответствующая  , линии серии сходятся к границе ионизации. В лаб. условиях наблюдения спектра водорода (напр., в электрич. разрядах) серия Лаймана получается как в поглощении, так и в испускании. В спектре Солнца наблюдается в поглощении и серия Бальмера (что связано с возбуждением при высоких темп-pax нач. уровня
, линии серии сходятся к границе ионизации. В лаб. условиях наблюдения спектра водорода (напр., в электрич. разрядах) серия Лаймана получается как в поглощении, так и в испускании. В спектре Солнца наблюдается в поглощении и серия Бальмера (что связано с возбуждением при высоких темп-pax нач. уровня 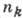 = 2).
= 2).
Сравнительно простыми спектрами обладают атомы щелочных металлов, имеющие один внеш. электрон (одноэлектронные А. с.), их спектральные линии также группируются в серии, волновые числа к-рых выражаются приближённой ф-лой Ридберга:
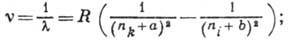
серия получается при заданном nk и разл. значениях ni; а и b постоянны для данной серии. Разл. серии (гл. серия, диффузная серия, резкая серия и др.) отличаются значениями а и b, зависящими от азимутального квантового числа l. Спектральные линии имеют дублетную тонкую структуру, причём величина расщепления быстро возрастает с увеличением Z (от Li к Cs).
Более сложными А. с. (двухэлектронными спектрами) обладают атомы с двумя внеш. электронами; ещё сложнее спектры атомов с тремя и более внеш. электронами. Систематика А. с. основана на характеристике уровней атома при помощи квантовых чисел и на отбора правилах,определяющих, какие из квантовых переходов возможны. При наличии одного внеш. электрона уровни энергии атома характеризуются (помимо гл. квантового числа электрона) его квантовыми числами l, s и j, определяющими величины орбитального момента 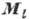 , спинового момента
, спинового момента 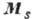 и полного момента
и полного момента 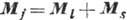 . Согласно правилам отбора
. Согласно правилам отбора 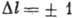 ,
, 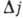 = 0
= 0 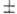 1. Для атомов с двумя или неск. внеш. электронами характеристика уровней энергии более сложна и может быть произведена исходя из приближённой характеристики одноэлектронных состояний при помощи квантовых чисел пi , li и si (li = 0, 1, 2,..., ni = 1,
1. Для атомов с двумя или неск. внеш. электронами характеристика уровней энергии более сложна и может быть произведена исходя из приближённой характеристики одноэлектронных состояний при помощи квантовых чисел пi , li и si (li = 0, 1, 2,..., ni = 1, 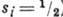 I и применяя векторную схему сложения орбитальных моментов
I и применяя векторную схему сложения орбитальных моментов 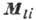 и спиновых моментов
и спиновых моментов 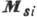 .
.
В случае нормальной связи, когда электростатич. взаимодействия электронов много больше их магн. взаимодействий, что чаще всего имеет место, орбитальные моменты отд. электронов 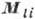 складываются в полный орбитальный момент
складываются в полный орбитальный момент 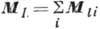 , а их спиновые моменты
, а их спиновые моменты 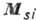 в полный спиновой момент
в полный спиновой момент 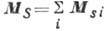 ; затем сложение
; затем сложение 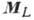 и
и 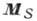 даёт полный момент атома:
даёт полный момент атома: 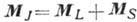 . Уровни энергии характеризуются значениями квантовых чисел L, S и J, определяющих величины соответствующих моментов. Квантовое число J сохраняет свой смысл и при др. схемах связи, когда в соответствии с величинами взаимодействий моменты следует складывать в др. последовательности [в частности, в случае
. Уровни энергии характеризуются значениями квантовых чисел L, S и J, определяющих величины соответствующих моментов. Квантовое число J сохраняет свой смысл и при др. схемах связи, когда в соответствии с величинами взаимодействий моменты следует складывать в др. последовательности [в частности, в случае  -связи
-связи
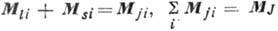 ; этот случай имеет место, когда магн. взаимодействия много больше электростатических]. J определяет величину полного момента атома независимо от схемы связи, и для него имеет место правило отбора
; этот случай имеет место, когда магн. взаимодействия много больше электростатических]. J определяет величину полного момента атома независимо от схемы связи, и для него имеет место правило отбора 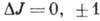 .\
.\
8. излучение возбуждённых атомов
Атом, находящийся в возбужденном состоянии, самопроизвольно переходит в основное состояние или на более низкий энергетический уровень. Излучение, испускаемое при самопроизвольном переходе из одного состояния в другое, называется спонтанным излучением. Спонтанное излучение различных атомов происходит индивидуально, так как каждый атом начинает и заканчивает излучение независимо от других. В 1916 г. Эйнштейн предсказал, что переход электрона в атоме с верхнего энергетического уровня на нижний и сопровождающее этот акт излучение могут происходить также под влиянием внешнего электромагнитного поля. Такое излучение называют вынужденным, или индуцированным. В результате взаимодействия возбужденного атома, готового испустить фотон с энергией hν = W 2− W 1, с фотоном hν, вынуждающим этот переход, получаются два совершенно одинаковых по энергии и направлению движения фотона-близнеца (рис1). Пролетающий фотон как бы "стряхивает" с возбужденного атома подобный себе фотон, не затрачивая на это энергию. С точки зрения волновой теории атом излучает электромагнитную волну, совершенно одинаковую по направлению распространения, частоте, фазе и поляризации с той, которая вынудила атом излучать. В итоге получается результирующая волна с амплитудой большей, чем у падающей. Особенностью индуцированного излучения является то, что оно монохроматично и когерентно.
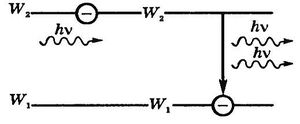

Рис1
При хаотическом тепловом движении распределение энергии среди атомов неравномерно. Некоторая часть атомов возбуждена, что соответствует их нахождению на более высоких, чем основной, уровнях энергии. В условиях теплового равновесия и при отсутствии внешнего электромагнитного поля большая часть атомов находится в невозбужденном состоянии. Образно говоря, населенность верхних уровней меньше населенности нижних.
Под влиянием внешних воздействий — повышения температуры, освещения, бомбардировки быстрыми частицами — доля возбужденных атомов возрастает, т.е. населенность верхних уровней увеличивается.
Казалось бы, по мере повышения температуры можно получить такое распределение частиц по уровням, при котором населенность верхних уровней больше, чем нижних. Но это не так. Ведь возбужденное состояние неустойчиво. По мере увеличения заселенности верхних уровней увеличивается вероятность спонтанных переходов, сопровождаемых излучением.
В 1939 г. В. А. Фабрикант высказал предположение о возможности создания такого распределения частиц по энергиям, при котором число возбужденных атомов больше числа атомов, находящихся в основном состоянии. Такое состояние называют состоянием с инверсной заселенностью уровней. Ему присущи особые свойства.
При распространении света в веществе обычно наблюдается поглощение света. Это происходит потому, что в состоянии термодинамического равновесия число невозбужденных атомов в веществе много больше, чем число возбужденных, и, следовательно, фотоны чаще взаимодействуют с невозбужденными атомами, т.е. поглощаются веществом.
В веществе же с инверсной населенностью уровней число возбужденных атомов больше числа невозбужденных. При этом уменьшается вероятность встречи фотонов с невозбужденным атомом, т.е. уменьшается вероятность поглощения фотонов. Вещество становится более прозрачным или даже способным усиливать свет. Действительно, если в нем движется фотон, энергия которого в точности равна разности энергий атомов в состояниях W2 и W1 то, взаимодействуя с возбужденным атомом, такой фотон вызовет индуцированное излучение. В результате появится второй такой же фотон. Взаимодействуя с другими двумя возбужденными атомами, эти два фотона вызовут "высвечивание" еще двух атомов. В конечном счете вместо одного фотона из вещества выйдет много фотонов, т.е. будет иметь место усиление света.
Среда называется активной, если в ней число индуцированных фотонов превышает число поглощенных.
Создать инверсную населенность в системе, состоящей из двух энергетических уровней путем длительного освещения вещества мощным световым импульсом, невозможно. Во-первых, с увеличением концентрации частиц на верхнем уровне возрастает вероятность спонтанных переходов; во-вторых, возбуждающее излучение вызывает индуцированное излучение, переводящее частицы на нижний уровень.
Иные возможности открываются при использовании веществ, среди энергетических состояний которых имеются такие возбужденные состояния, в которых атомы могут находиться значительно дольше, чем 10-8 с. Такие состояния и соответствующие им уровни энергии называют метастабильными.
Пусть уровень 2 с энергией W2 (рис. 20.11, а) метастабильный, характеризуемый "временем жизни" в 1000 раз больше, чем "время жизни" уровня 3 W3 (τ ∼10−8 с).
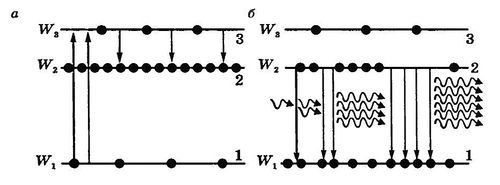

Рис. 20.11
При наличии уровня 2 возможны спонтанные переходы из состояния 3 не только в основное состояние 2, но и на метастабильный уровень 2. Оба перехода сопровождаются излучением электронов соответствующей энергии:
hν 31= W 3− W 1,
hν 32= W 3− W 2.
Большое различие во временах жизни в состояниях 3 и 2 приводит к тому, что под действием возбуждающего фотона с энергией hν 31≥ W 3− W 1, атомы переходят сначала в состояние 3, а затем, излучая фотон с энергией hν 32≥ W 3− W 2, — в состояние 2. В результате происходит накопление атомов в метастабильном состоянии 2. Со временем их число оказывается большим числа атомов в основном состоянии 1. Значит, в веществе с такой системой уровней действием возбуждающего излучения hν 31≥ W 3− W 1, может быть создана инверсная населенность уровней.
Если направить в предварительно подготовленное таким образом вещество квант электромагнитного излучения hν 21≥ W 2− W 1, то вследствие явления индуцированного излучения произойдет усиление света, что условно и показано на рис. 20.11, б. Число фотонов увеличивается в геометрической прогрессии. На выходе усилителя света фотонов больше, чем на входе.
Система атомов с инверсной населенностью уровней способна не только усиливать, но и генерировать электромагнитное излучение. Для работы в режиме генератора необходима положительная обратная связь, при которой часть сигнала с выхода устройства подается на его вход. Для этого активная среда, в которой создается инверсная населенность уровней, располагается в резонаторе, состоящем из двух параллельных зеркал.
В результате одного из спонтанных переходов атомов с метастабильного уровня на основной возникает фотон с энергией hν 21≥ W 2− W 1. При движении в сторону одного из зеркал этот фотон вызывает индуцированное излучение и к зеркалу подходит целая лавина фотонов с энергией hν 21 каждый. После отражения от зеркала лавина фотонов движется в противоположном направлении, попутно заставляя высвечиваться с метастабильного уровня возбужденные атомы, оставшиеся в этом состоянии.
Дата добавления: 2015-07-12; просмотров: 129 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гипотеза Де Бройля. Дифракция электронов | | | Рентгеновские излучение и его природа |