
Читайте также:
|
1. Концентрация субстрата [S]
2. Концентрация фермента [F]
3. Температура
4. рН
5. Низкомолекулярные вещества (активаторы, ингибиторы).
Концентрация субстрата зависит от питания, возраста, физической нагрузки.
Зависимость скорости ферментативной реакции субстрата выражается уравнением Михаэлиса-Ментен:

Vmax – максимальная скорость реакции
[S] – концентрация субстрата
Km – константа Михаэлиса.
Анализ уравнения Михаэлиса-Ментен.
1. Концентрация субстрата мала, стремиться к нулю. При этих условиях [S] можно пренебречь:
[S]  0, при этом [S] можно пренебречь:
0, при этом [S] можно пренебречь:

2. Концентрация субстрата стремится к бесконечности, пренебрегаем Km и уравнение имеет вид:
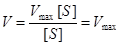
Сокращаем на [S] и скорость реакции равняется Vmax.
3. Если принять, что 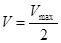 , то из уравнения Михаэлиса-Ментен, разделив его на Vmax, получили Km=[S]:
, то из уравнения Михаэлиса-Ментен, разделив его на Vmax, получили Km=[S]:
 и разделив на Vmax получим
и разделив на Vmax получим  . Решая уравнение относительно Km получаем Km+[S] = 2[S],
. Решая уравнение относительно Km получаем Km+[S] = 2[S],
Km=[S]
Km – величина, численно равная концентрации субстрата при 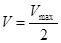 , выраженная в молях. Km = 10-1 – 10-6 – для клеток организма, величина const.
, выраженная в молях. Km = 10-1 – 10-6 – для клеток организма, величина const.
Km показывает:
1. Степень сродства между ферментом и субстратом, существует обратная зависимость – чем меньше Km, тем больше сродство F к S.
2. Km позволяет определить какой субстрат будет превращаться под действием данного фермента:
Например, этиленгликоль – составная часть антифриза и алкагольдегидрогеназа (АДГ) будет превращать его в щавелевую кислоту, которая является ядом для печени.
Алкагольдегидрогеназа превращает этиловый спирт в уксусный альдегид и степень сродства АДГ к С2Н5ОН выше, чем к этиленгликолю и на этом основан способ нейтрализации этиленгликоля.
3. Km показывает степень сродства между белковой и небелковой частью F, 
4. Km позволяет определить вид ингибирования.
Способ определения Km.
1. Построение график Михаэлиса-Ментен:

I участок – с увеличением концентрации субстрата увеличивается скорость ферментативной реакции
II участок – с увеличением концентрации субстрата скорость реакции не изменяется, т.к. все активные центры заняты.
Недостаток графика Михаэлиса-Ментен при определении Km заключается в том, что Vmax достигается с трудом, реакции в клетке протекают с оптимальной скоростью, а не Vmax.
2. Построение графика Лайнуэвера-Бэрка – метод обратных величин
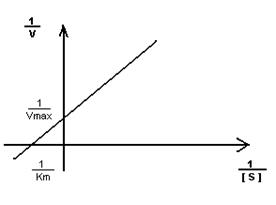
Преимущество метода заключается в том, что прямую можно построить по двум точкам и нет необходимости определять максимальную скорость.
Зависимость скорости ферментативной реакции от концентрации фермента.
Зависимость носит линейный характер. Скорость химической реакции, катализируемой данным ферментом прямопропорциональна  концентрации фермента. При этом концентрация субстрата величина постоянная. Это обясняетя большим количеством активных центров при определенном количестве молекул субстрата
концентрации фермента. При этом концентрация субстрата величина постоянная. Это обясняетя большим количеством активных центров при определенном количестве молекул субстрата
Зависимость скорости ферментативной реакции от температуры.
 При t=36-380 ферменты обладают наибольшей активностью. Эта температура называется температурный оптимум:
При t=36-380 ферменты обладают наибольшей активностью. Эта температура называется температурный оптимум:
С повышением t0 до оптимума активность ферментов повышается.
Высокие t вызывают денатурацию ферментов.
Низкие t снижают активность ферментов.
Изменение t0 приводит к нарушению связей, закрепляющих белковую структуру ферментов (третичную, четвертичную), т.е. вызывает денатурацию.
Обратимая денатурация наблюдается при понижении t0. Это позволяет хранить ферменты, биологические жидкости, кровь.
Повышение температуры необратимо нарушает белковую структуру фермента. Это свойство используется при стерилизации материалов, инструментов.
Лихорадка – защитное свойство организма, т.к. происходит денатурация ферментов микроорганизмов и поэтому нецелесообразно применять жаропонижающие средства.
Дата добавления: 2015-10-13; просмотров: 181 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Изоферменты. | | | Классификация ферментов. |