
|
Читайте также: |
В расчетах орбиталей двухатомной молекулы водорода используется приближение атомной  орбитали (АО) атома водорода. При сближении атомов водорода до некоторого расстояния ядро каждого из атомов начнет притягивать электрон, первоначально связанный только со своим атомом. Можно предположить, что если электрон находится около «своего» ядра водорода, его молекулярная орбиталь сходна с атомной орбиталью
орбитали (АО) атома водорода. При сближении атомов водорода до некоторого расстояния ядро каждого из атомов начнет притягивать электрон, первоначально связанный только со своим атомом. Можно предположить, что если электрон находится около «своего» ядра водорода, его молекулярная орбиталь сходна с атомной орбиталью  этого атома. Если электрон оказывается вблизи другого ядра, МО сходна с АО
этого атома. Если электрон оказывается вблизи другого ядра, МО сходна с АО  . Поскольку МО характеризуется то
. Поскольку МО характеризуется то  -, то
-, то  -атомной орбиталью, то ее м/о представить лин комбинацией атомных орбиталей:
-атомной орбиталью, то ее м/о представить лин комбинацией атомных орбиталей: 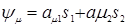 ,
,  .
.
Коэффициенты  и
и  определяются из уравнений:
определяются из уравнений:  ,
,
 , Из симметрии молекулы водорода следует, что
, Из симметрии молекулы водорода следует, что  и
и 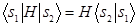 . Базисные атомные орбитали полагаются ортонормированными
. Базисные атомные орбитали полагаются ортонормированными  и
и 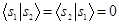 , ортогональность вводится для облегчения расчетов.
, ортогональность вводится для облегчения расчетов.
Диагональные матричные элементы обозначаются как  ,
,  , недиагональные элементы
, недиагональные элементы  ,
,  . Недиагональные элементы в теории твердых тел называются интегралами перескока, в теории молекул – резонансными интегралами.
. Недиагональные элементы в теории твердых тел называются интегралами перескока, в теории молекул – резонансными интегралами.
Численные значения кулоновских интегралов приближенно равны энергиям атомных орбиталей (АО) в атоме. Приближенно можно можно считать, что при изменении расстояния между атомами в молекуле они не изменяются.
Резонансные интегралы 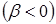 характеризуют взаимодействие АО разных атомов и с увеличением расстояния между атомами быстро убывают по абсолютной величине.
характеризуют взаимодействие АО разных атомов и с увеличением расстояния между атомами быстро убывают по абсолютной величине.
В соответствии с приведенными уравнениями из  -АО атомов водорода возможно образование двух молекулярных орбиталей:
-АО атомов водорода возможно образование двух молекулярных орбиталей: 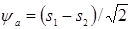 и
и  с энергиями
с энергиями  и
и  . Сложение двух атомных орбиталей означает, что два электрона в молекуле водорода теперь охватывает два ядра, и молекулярная орбиталь
. Сложение двух атомных орбиталей означает, что два электрона в молекуле водорода теперь охватывает два ядра, и молекулярная орбиталь  является двухцентровой. При этом оба электрона проводят большую часть времени между двумя ядрами. Орбиталь
является двухцентровой. При этом оба электрона проводят большую часть времени между двумя ядрами. Орбиталь  называется связывающей орбиталью.
называется связывающей орбиталью.
Вторая линейная комбинация  водородных АО характеризуется нулевой вероятностью нахождения между атомами и ст
водородных АО характеризуется нулевой вероятностью нахождения между атомами и ст  ремится разъединить атомы, поэтому она называется разрыхляющей, антисвяывающей. Орбитали симметричны относительно оси вращения молекулы
ремится разъединить атомы, поэтому она называется разрыхляющей, антисвяывающей. Орбитали симметричны относительно оси вращения молекулы  . Молекулярные орбитали, обладающие такой симметрией, называются орбиталями
. Молекулярные орбитали, обладающие такой симметрией, называются орбиталями  - типа. Разрыхляющую орбиталь обозначают
- типа. Разрыхляющую орбиталь обозначают  , связывающую -
, связывающую -  .
.
Основное состояние молекулярного иона 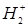 характеризуется конфигурацией
характеризуется конфигурацией  с электроном на связывающей МО одним
с электроном на связывающей МО одним  .
.
Дата добавления: 2015-09-02; просмотров: 62 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Секулярное уравнение | | | Трансляционная симметрия полимеров |