
Читайте также:
|
Раскрыв скобки в уравнении (3) и умножив на 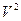 , получаем
, получаем
 (4)
(4)
Мы получили кубическое уравнение относительно  , коэффициенты которого зависят от параметров
, коэффициенты которого зависят от параметров  .
.
В зависимости от соотношения между коэффициентами решения уравнения могут быть либо все три вещественными, либо одно вещественное и два комплексных, не имеющих физического смысла.
 На рис.6.5 изображены изотермы Ван-дер-Ваальса для нескольких значений температуры.
На рис.6.5 изображены изотермы Ван-дер-Ваальса для нескольких значений температуры.
При температуре  и давлении в пределах от
и давлении в пределах от  до
до  коэффициенты в (4) таковы, что все три решения вещественные; при других коэффициентах уравнение имеет только одно вещественное решение.
коэффициенты в (4) таковы, что все три решения вещественные; при других коэффициентах уравнение имеет только одно вещественное решение.
Различие между тремя вещественными решениями с ростом температуры уменьшается (ср. изотермы  и
и  ,
,  >
>  ).
).
Начиная с определенной, своей для каждого вещества температуры  вещественным остается только одно решение уравнения (4). Температура
вещественным остается только одно решение уравнения (4). Температура  , называемая критической.
, называемая критической.
Если повышать температуру, то точки, соответствующие решениям уравнения  ,
,  ,
,  все больше сближаются, сливаясь при критической температуре в одну точку (на рис. Точка К).
все больше сближаются, сливаясь при критической температуре в одну точку (на рис. Точка К).
Точка К называется к ритической. Ей соответствуют три совпадающих вещественных решения уравнения (4). Касательная к критической изотерме в точке К является пределом, к которым стремятся секущие  и
и  и т.д. при приближении температуры к критической. Следовательно, эта касательная, ак и все секущие, параллельна оси V, так, что производная
и т.д. при приближении температуры к критической. Следовательно, эта касательная, ак и все секущие, параллельна оси V, так, что производная 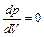 в точке К. Кроме того в точке перегиба должна быть равна нулю и вторая производная
в точке К. Кроме того в точке перегиба должна быть равна нулю и вторая производная 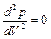
Из уравнения (1) выразим давление: 
Продифференцируем это уравнение по  :
: 
В критической точке при  эти выражения должны обращаться в ноль:
эти выражения должны обращаться в ноль:


Для критической точки 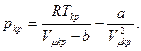
Мы получили систему из трех уравнений с неизвестными  .
.
Решение этой системы имеет вид 
Таким образом, зная константы Ван-дер-Ваальса  и, можно найти соответствующие критической точке
и, можно найти соответствующие критической точке  , которые называются критическими величинами. И, наоборот, по известным критическим величинам могут быть найдены значения констант Ван-де- Ваальса.
, которые называются критическими величинами. И, наоборот, по известным критическим величинам могут быть найдены значения констант Ван-де- Ваальса.
Для критических величин  , в то время как
, в то время как
согласно уравнению Менделеева - Клапейрона для идеального газа  .
.
Дата добавления: 2015-08-21; просмотров: 144 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Эта константа равна учетверенному объему молекул. | | | Внутренняя энергия реального газа. |