
|
Читайте также: |
48. Межмолекулярное взаимодействие. Когда вещество находится в газообразном состоянии, тогда образующие его частицы — молекулы или атомы — хаотически движутся и при этом преобладающую часть времени находятся на больших (в сравнении с их собственными размерами) расстояниях друг от друга. Вследствие этого силы взаимодействия между ними пренебрежимо малы.
Иначе обстоит дело, когда вещество находится в конденсированном состоянии — в жидком или в твердом. Здесь расстояния между частицами вещества малы и силы взаимодействия между ними велики. Эти силы удерживают частицы жидкости или {твердого тела друг около друга. Поэтому вещества в конденсированном состоянии имеют, в отличие от газов, постоянный при данной температуре объем.
Силы, удерживающие частицы жидкости или твердого тела друг около друга, имеют электрическую природу. Но в зависимости от того, что представляют собой частицы —являются ли они атомами металлического или неметаллического элемента, ионами или молекулами, — эти силы существенно различны.
Если вещество построено из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью. Если вещество — металл, то часть электронов его атомов становятся общими для всех атомов; эти электроны свободно движутся между атомами, связывая их друг с другом. Если вещество имеет ионное строение, то образующие его ионы удерживаются друг около друга силами электростатического притяжения. О ковалентной и ионной связи говорилось в главе IV. О связи между частицами в металлах рассказывается в главе XVI. В веществах с молекулярной структурой имеет место меж молекулярное взаимодействие.
Силы межмолекулярного взаимодействия, называемые также силами Ван-дер-Ваальса, слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Если вещество состоит из полярных молекул, например, молекул Н2О или НС1, то в конденсированном состоянии соседние молекулярные диполи ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствие чего наблюдается их взаимное притяжение. Такой вид межмолекулярного взаимодействия называется ориентационным взаимодействием. Тепловое движение молекул препятствует взаимной ориентации молекул, поэтому с ростом температуры ориентационный1 эффект ослабевает.
В случае веществ, состоящих из неполярных, но способных к поляризации молекул, например, СОг, наблюдается возникновение наведенных или индуцированных диполей. Причина их появления обычно состоит в том, что каждый атом создает вблизи себя электрическое поле, оказывающее поляризующее действие на ближайший атом соседней молекз^лы. Молекула поляризуется, и образовавшийся индуцированный диполь в свою очередь поляризует соседние молекулы. В результате происходит взаимное притяжение молекул друг к другу. Это индукционное взаимодействие наблюдается также и у веществ с полярными молекулами, но при этом оно обычно значительно слабее ориентационного.
Наконец, движение электронов в атомах, а также колебание ядер и связанное с этим непрерывное изменение взаимного положения электронов и ядер вызывают появление мгновенных диполей. Как показывает квантовая механика, мгновенные диполи воз
никают в твердых телах и жидкостях согласованно, причем ближайшие друг к другу участки соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к их притяжению. Это явление, называемое дисперсионным взаимодействием, имеет место во всех веществах, находящихся в конденсированном состоянии. В частности, оно обусловливает переход благородных газов при низких температурах в жидкое состояние.
Относительная величина рассмотренных видов межмолекулярных сил зависит от полярности и от поляризуемости молекул вещества. Чем больше полярность молекул, тем больше ориентацион- ные силы. Чем больше деформируемость, чем слабее связаны внешние электроны атомов, т. е. чем эти атомы крупнее, тем значительнее дисперсионные силы. Таким образом, в ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ. Например, в случае НС1 на долю дисперсионных сил приходится 81 % всего межмолекулярного взаимодействия, для НВг эта величина составляет 95%, а для HI 99,5%. Индукционные силы почти всегда малы.
49. Кристаллическое состояние вещества. В твердом состоянии большинство веществ имеет кристаллическое строение. В этом легко убедиться, расколов кусок вещества и рассмотрев полученный излом. Обычно на изломе (например, у сахара, серы, металлов) хорошо заметны расположенные под разными углами мелкие грани кристаллов, поблескивающие вследствие различного отражения ими света. В тех случаях, когда кристаллы очень малы, кристаллическое строение вещества можно установить при помощи микроскопа.
Каждое вещество обычно образует кристаллы совершенно определенной формы. Например, хлорид натрия кристаллизуется в форме кубов (рис. 59,а), квасцы — в форме октаэдров (рис. 59,6), нитрат натрия — в форме призм (рис. 59, е) и т. д. Кристаллическая форма — одно из характерных свойств вещества.

|
Классификация кристаллических форм основана на симметрии кристаллов. Различные случаи симметрии кристаллических многогранников подробно разбираются в курсах кристаллографии. Здесь укажем только, что все разнообразие кристаллических форм может быть сведено к семи группам, или кристаллическим системам, которые, в свою очередь, подразделяются на классы. а.
J-----
Рис. 59. Формы кристаллов: а — хлорид натрия; б — квасцы; в — нитрат натрия.
Рис. 60. Бруски, вырезанные из кристаллов каменной соли:
а — в направлении, перпендикулярном граням куба; б —в направлении диагонали одной из граней куба.
Многие вещества, в частности железо, медь, алмаз, хлорид натрия, кристаллизуются в кубической системе. Про- стейшими формами этой системы являются куб, октаэдр, тетраэдр. Магний, цинк, лед, кварц кристаллизуются в гексагональной системе. Основные формы этой системы — шестигранные призма и бипирамида.
Природные кристаллы, а также кристаллы, получаемые искусственным путем, редко в точности соответствуют теоретическим формам. Обычно при затвердевании расплавленного вещества кристаллы срастаются вместе и потому форма каждого из них оказывается не вполне правильной. При быстром выделении вещества из раствора тоже получаются кристаллы, форма которых искажена вследствие неравномерного роста в условиях кристаллизации.
Однако как бы неравномерно ни происходило развитие кристалла, как бы ни была искажена его форма, углы, под которыми сходятся грани кристалла данного вещества, остаются одними и теми же. Это один из основных законов кристаллографии — закон постоянства гранных углов. Поэтому по величине двугранных углов в кристалле можно установить, к какой кристаллической системе и к какому классу относится данный кристалл.
Особенности кристаллических тел не ограничиваются только формой кристаллов. Хотя вещество в кристалле совершенно однородно, многие из его физических свойств — прочность, теплопроводность, отношение к свету и др. — не всегда одинаковы по различным направлениям внутри кристалла. Эта важная особенность кристаллических веществ называется анизотропией.
Вырежем, например, в различных направлениях из кубического кристалла каменной соли два одинаковой толщины бруска (рис. 60) и определим сопротивление этих брусков разрыву. Оказывается, что для разрыва второго бруска требуется сила в 2,5 раза большая, чем для разрыва первого бруска. Очевидно, что прочность кристаллов каменной соли в направлении, перпендикулярном граням куба, в 2,5 раза меньше, чем в направлении диагоналей.
Во многих кристаллах различие между прочностью по разным направлениям настолько велико, что при ударе или разламывании они раскалываются по тем плоскостям, перпендикулярно к которым прочность минимальна. Это свойство кристаллов называется спайностью. Примером проявления спайности могут служить кристаллы слюды, раскалывающейся, как известно, на тончайшие пластинки.

|
50. Внутреннее строение кристаллов. Давно предполагали, что внешняя форма кристалла отражает его внутреннее строение и обусловлена правильным расположением частиц, составляющих кристалл, — молекул, атомов или ионов. Это расположение можгщ
представить в виде кристаллической решетки — пространственного каркаса, образованного пересекающимися прямыми линиями. В точках пересечения линий — узлах решетки—< лежат центры частиц.
Исследовать внутреннюю структуру кристаллов удалось в XX веке, после того, как в 1912 г. была открыта дифракция рентгеновских лучей, на которой основан рентгеноструктурный анализ.
При падении пучка монохроматических (т. е. одинаковых по длине волны)" рентгеновских лучей на грань кристалла большая часть пучка проходит через кристалл, но некоторая его доля претерпевает отражение. Это отражение происходит от плоскостей, образованных частицами, составляющими кристаллическую решетку данного вещества. Такие плоскости играют роль штрихов дифракционной решетки; расстояния между ними близки к длинам волн рентгеновских лучей, поэтому последние, отражаясь от параллельных плоскостей, интерферируют друг с другом. При определенных углах падения пучка лучей на грань кристалла наблюдается усиление отраженного луча, которое регистрируется на фотопленке — получается рентгенограмма данного кристалла. Расшифровка ее, при известной длине волны применяемого излучения, приводит к определению расстояний между соседними плоскостями или, что то же самое, между соседними атомами (ионами) в кристалле данного вещества.
Рентгеноструктурный анализ служит основным методом изучения строения твердых тел. В некоторых случаях используют дифракцию электронов (электронографический анализ), а также нейтронов. В настоящее время методами рентгеноструктурного анализа изучено строение десятков тысяч неорганических и органических веществ, имеющих практич'еское и научное значение. Большие успехи достигнуты в расшифровке структур биологически важных веществ (например, гемоглобина). Благодаря применению методов рентгеноструктурного анализа устанавливается молекулярное строение наследственного вещества живых организмов.
В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от того, какие силы взаимодействия между ними преобладают в данном кристалле, различают молекулярные, атомные, ионные и металлические решетки.
В узлах молекулярных решеток находятся молекулы. Они связаны друг с другом межмолекулярными силами. В узлах атомных решеток находятся атомы; они связаны друг с другом ковалентной связью. В узлах ионных решеток располагаются, чередуясь, положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения. Наконец, в узлах металлических решеток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны. Металлические решетки рассматриваются в гл. XVI.
Молекулярные и атомные решетки присущи веществам с ковалентной связью, ионные — ионным соединениям, металлические — металлам и их сплавам.
Веществ, обладающих атомными решетками, сравнительно мало. К ним принадлежат алмаз, кремний и некоторые неорганические соединения. Эти вещества характеризуются высокой твердостью, они тугоплавки и нерастворимы практически ни в каких растворителях. Такие их свойства обусловлены прочностью ковалентной связи.
Веществ с молекулярной решеткой очень много. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические вещества. Силы межмолекулярного взаимодействия значительно слабее сил ковалентной связи, поэтому молекулярные кристаллы имеют небольшую твердость, легкоплавки и летучи.
К соединениям с ионной связью, образующим ионные решетки, относится большинство солей и небольшое число оксидов. По прочности ионные решетки уступают атомным, но превышают молекулярные. Ионные соединения имеют сравнительно высокие температуры плавления; летучесть их в большинстве случаев невелика.
Существуют вещества, в кристаллах которых значительную роль играют два рода взаимодействия между частицами. Так, в графите атомы углерода связаны друг с другом в одних направлениях ковалентной связью, а в других — металлической. Поэтому решетку графита можно рассматривать и как атомную, и как металлическую. Во многих неорганических соединениях, например, в BeO, ZnS, CuCl, связь между частицами, находящимися в узлах решетки, является частично ионной и частично ковалентной; решетки подобных соединений можно рассматривать как промежуточные между ионными и атомными.
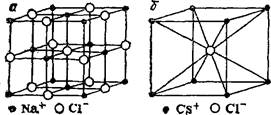
|
| Рис. 61. Кристаллические решетки хлорида натрия (а) и хлорида цезия (б). |
Решетки различных веществ различаются между собой не только по природе образующих их частиц, но и по взаимному расположению частиц в пространстве — по своему строению. Каждую решетку можно охарактеризовать ее элементарной ячейкой— наименьшей частью кристалла, имеющей все особенности структуры данной решетки (см. рис. 61). Как видно, в кристалле NaCl каждый ион окружен шестью ближайшими ионами противоположного знака, а в кристалле CsCI — восемью. Это число ближайших частиц для той или иной частицы в кристалле называется ее координационным числом. Таким образом, координационное число иона Na+ и иона С1_ в кристалле NaCl равно 6, а ионов Cs+ и С1~ в кристаллах CsCI равно 8. В кристаллах обеих
этих солей, а также других ионных соединений все связи каждого иона с ближайшими ионами противоположного знака равноценны, Отсюда следует, что понятие о молекуле неприменимо к кристаллическим веществам с ионной связью. Также неприменимо это понятие и к кристаллам с атомной или смешанной атомно-ионной структурой. В таких веществах, как алмаз, карборунд SiC, имеющих атомную решетку, или как ZnS, А1203, обладающих промежуточной атомно-ионной структурой, все связи каждого атома с ближайшими соседними атомами равноценны.
51. Реальные кристаллы. Описанная в § 50 внутренняя структура кристалла, характеризующаяся строгой пространственной периодичностью, представляет собой известную идеализацию. Исследование строения реальных кристаллов показало, что во всяком кристалле эта периодичность всегда несколько нарушена. В реальных кристаллах наблюдаются дефекты структуры. Число этих дефектов и их тип оказывают влияние на некоторые свойства кристаллических веществ. В ряде случаев это влияние очень сильно, а некоторых из таких структурно-чувствительных свойств имеют очень большое практическое значение.
Дефекты структуры реальных кристаллов разнообразны. Прежде всего различают точечные, линейные и поверхностные дефекты. Простейшие и в то же время важнейшие точечные дефекты — это незанятые узлы решетки, или вакансии, и атомы, находящиеся в междуузлиях. Существование таких дефектов связано с тем, что отдельные атомы или ионы решетки имеют энергию, превышающую ее среднее значение при данной температуре. Такие атомы колеблются интенсивнее других и могут переместиться с одного места на другое, например, из узла решетки в междуузлие. Вышедший из узла атом называется дислоцированным, а незаполненное место, где он ранее находился, — вакансией. В любой момент соседний с вакансией атом может перейти на ее место, освободив новую вакансию. Таким образом, вакансии переходят с одного места на другое. Точечные дефекты оказывают очень большое влияние на свойства полупроводниковых материалов.
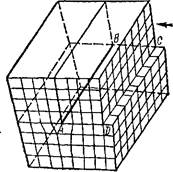
Линейные дефекты структуры называются дислокациями. Простейший вид дислокации — краевая дислокация. Она представляет собой край одной из атомных плоскостей, обрывающейся внутри кристалла. Дислокации возникают как в процессе роста кристаллов, так и при местных механических, тепловых и других воздействиях на кристаллы (см., например, рис. 142, а, б на стр 521). На рис. 62 изображена краевая дислокация (линия АВ), возникшая в результате сдвига части кристалла по плоскости ABCD в направлении, указанном стрелкой.
Подобно точечным дефектам, дислокации подвижны. Их подвижность особенно велика в случае металлических кристаллов. Механические свойства металлов сильно зависят от плотности
Рис. 62. Схема краевой дислокации.
дислокаций (т. е. от числа в единице объема) и от их способности к перемещению по кристаллу (см. стр. 520, 521).
Поверхностные дефекты, наблюдаемые на поверхности кристаллического тела или на границе кристаллов между собою, представляют комбинации большого числа различных точечных и линейных дефектов.
52. Аморфное состояние вещества. Среди твердых тел встречаются такие, в изломе которых нельзя обнаружить никаких признаков кристаллов. Например, если расколоть кусок обыкновенного стекла, то излом его окажется гладким и, в отличие от изломов кристаллов, ограничен не плоскими, а овальными поверхностями. Подобная же картина наблюдается при раскалывании кусков смолы, клея и некоторых других веществ. Такое состояние вещества называют аморфным.
Различие между кристаллическими и аморфными телами особенно резко проявляется в их отношении к нагреванию. В то время как кристаллы каждого вещества плавятся при строго определенной температуре и при той же температуре происходит переход из жидкого состояния в твердое, аморфные тела не имеют определенной температуры плавления. При нагревании аморфное тело постепенно размягчается, начинает растекаться и, наконец, становится совсем жидким. При охлаждении оно также постепенно затвердевает.
В связи с отсутствием определенной температуры плавления аморфные тела обладают и другой особенностью: многие из них подобно жидкостям текучи, т. е. при длительном действии сравнительно небольших сил постепенно изменяют свою форму. Например, кусок смолы, положенный на плоскую поверхность, в теплом помещении за несколько недель растекается, принимая форму диска.
|
В отношении внутреннего строения различие между кристаллическим и аморфным состояниями вещества состоит в следующем. Упорядоченное расположение частиц в кристалле, отражаемое элементарной ячейкой, сохраняется на больших участках кристаллов, а в случае хорошо образованных кристаллов — во всем их объеме. В аморфных телах упорядоченность в расположении частиц наблюдается только на очень малых участках. Кроме того, в ряде аморфных тел даже эта местная упорядоченность носит лишь приблизительный характер. Это различие можно коротко сформулировать следующим образом: структура кристаллов ха-
растеризуется дальним порядком, структура аморфных тел — ближним.
f Аморфное состояние характерно, например, для силикатных стекол (§ 182). Некоторые вещества могут находиться как в кристаллическом, так и в аморфном состоянии. Например, диоксид кремния SiCh встречается в природе в виде хорошо образованных кристаллов кварца, а также в аморфном состоянии (минерал кремень). При этом кристаллическое состояние всегда более устойчиво. Поэтому самопроизвольный переход вещества из кристаллического состояния в аморфное невозможен, а обратное превращение— самопроизвольный переход из аморфного состояния в кристаллическое — возможно и иногда наблюдается. Примером такого превращения служит расстеклование — самопроизвольная кристаллизация стекла при повышенных температурах, сопровождающаяся разрушением его.
53. Жидкости. Жидкое состояние является промежуточным между газообразным и кристаллическим. По одним свойствам жидкости близки к газам, по другим — к твердым телам. С газами жидкости сближает прежде всего их изотропность и текучесть; последняя обусловливает способность жидкости легко изменять внешнюю форму. Однако высокая плотность и малая сжимаемость жидкостей приближает их к твердым телам.
Способность жидкостей легко изменять свою форму говорит об отсутствии в них жестких сил межмолекулярного взаимодействия. В то же время низкая сжимаемость жидкостей, обусловливающая способность сохранять постоянный при данной температуре объем, указывает на присутствие хотя и не жестких, но все же значительных сил взаимодействия между частицами.
Для каждого агрегатного состояния характерно свое соотношение между потенциальной и кинетической энергиями частиц вещества. У твердых тел средняя потенциальная энергия частиц больше их средней кинетической энергии. Поэтому в твердых телах частицы занимают определенные положения друг относительно друга и лишь колеблются около этих положений. Для газов соотношение энергий обратное, вследствие чего молекулы газа всегда находятся в состоянии хаотического движения и силы сцепления между молекулами практически отсутствуют, так что газ всегда занимает весь предоставленный ему объем. В случае жидкостей кинетическая и потенциальная энергии частиц приблизительно одинаковы, т. е. частицы связаны друг с другом, но не жестко. Поэтому жидкости текучи, но имеют постоянный при данной температуре объем.
В результате применения к жидкостям методов структурного анализа установлено, что по структуре жидкости подобны аморфным телам. В большинстве жидкостей наблюдается ближний порядок — число ближайших соседей у каждой молекулы и их взаимное расположение приблизительно одинаковы во всем объеме данной жидкости.
Степень упорядоченности частиц у различных жидкостей различна. Кроме того, она изменяется при изменении температуры. При низких температурах, незначительно превышающих температуру плавления данного вещества, степень упорядоченности расположения частиц данной жидкости велика. С ростом температуры она падает, и по мере нагревания свойства жидкости все больше и больше приближаются к свойствам газа. При достижении критической температуры (см. § 71) различие между жидкостью и газом исчезает.
Вследствие сходства во внутренней структуре жидкостей и аморфных тел последние, часто рассматриваются как жидкости с очень высокой вязкостью, а к твердым телам относят только вещества в кристаллическом состоянии. Уподобляя аморфные тела жидкостям, следует, однако, помнить, что в аморфных телах, в отличие от обычных жидкостей, частицы имеют незначительную подвижность — такую же, как в кристаллах.
Дата добавления: 2015-08-21; просмотров: 145 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| IV И СТРОЕНИЕ МОЛЕКУЛ 4 страница | | | V! ХИМИЧЕСКИХ РЕАКЦИЙ |