
|
Читайте также: |
d-Елементи VIII групи
1. Які ступені окиснення характерні для заліза, кобальту та нікелю? Наведіть по два приклади сполук цих елементів у характерних ступенях окиснення та назвіть їх.
2. Як взаємодіють залізо, кобальт та нікель з нітратною, сульфатною та хлоридної кислотами? Як ці метали взаємодіють з водою, з водними розчинами солей?
3. Проаналізуйте реакції гідролізу FeS та FeSO4. Для FeSO4 напишіть рівняння першого ступеня гідролізу.
4. Що більше гідролізується:
а) FeCl3 або FeCl2;
б) FeCl3 або K3[Fe(CN)6];
в) FeCl3 або K3[Fe(ОН)6];
г) FeCl3 або K2FeO4.
5. Як змінюється стійкість до окиснення в ряду Fe (II) – Co (II) – Ni (II)? Як змінюється окиснювальна здатність в ряду Fe (IIІ) – Co (IIІ) – Ni (IIІ)? Охарактеризуйте умови отримання гідроксидів Me(ОН)2 та Me(ОН)3.
6. Напишіть рівняння реакцій, за допомоги яких можна здійснити перетворення:
а) 
б) 
в) 
7. Закінчіть рівняння реакцій:
а) 
б) 
в) 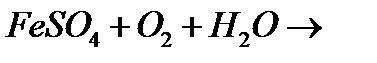
г) 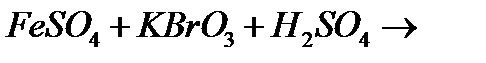
ґ) 
д) 
е) 
є) 
ж) 
з) 
и) 
і) 
ї) 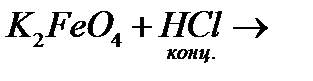
й) 
8. Наведіть характерні реакції на іони Fe2+ та Fe3+.
d-Елементи І групи
1. Охарактеризуйте будову атомів d-елементів І групи. Яка електронна конфігурація їх передзовнішніх та зовнішніх енергетичних рівнів в основному стані? Які орбіталі в атомах міді, срібла та золота є валентними?
2. Розгляньте зміну атомних радіусів, енергій іонізації, спорідненості до електрону та електронегативності в ряду Cu-Ag. Чому радіус атома міді (Z=29) менше радіусу атома калію (Z=19)? Чому радіуси атомів срібла (Z=47) та золота (Z=79) практично однакові?
3. Які ступені окиснення відомі для атомів елементів, що розглядаються? Які з них найбільш характерні для міді; для срібла; для золота?
4. Оцініть відновлювальні властивості простих речовин. Як вони змінюються в ряду Cu-Au?
5. Які властивості золота дозволяють відносити його до благородних металів? Розгляньте відношення вказаних металів до кисню, галогенів, сірки.
6. Охарактеризуйте відношення міді, срібла та золота до розбавлених та концентрованих розчинів кислот, до розчинів лугів та солей. Напишіть рівняння відновних реакцій, вкажіть умови їх протікання.
7. Які реакції протікають при розчиненні золота у «царській горілці», у концентрованій хлоридній кислоті, яка насичена хлором, у селеновій кислоті?
8. Чим пояснюється утворення зеленого нальоту на мідних виробах та почорніння срібних предметів за тривалого знаходження їх на повітрі? Напишіть рівняння відповідних реакцій.
9. У вигляді яких часток можуть знаходитись у водних розчинах мідь, срібло та золото? Чи характерно для золота (ІІІ) утворення гідратованих катіонів?
10. Порівняйте окиснювальні властивості катіонів Cu2+ та Ag+ у водних розчинах. Який з них відновлюється на катоді при електролізі у першу чергу?
11. Який вплив ступеня окиснення металу на кислотно-основні властивості оксидів та гідроксидів міді та золота? Які з них володіють амфотерними властивостями? У якого гідроксиду – Cu(OH)2 або Au(OH)3 більш сильно виражені кислотні властивості? Яка сполука золота називається «золота кислота»? Напишіть рівняння реакцій, що протікають при розчиненні вказаних гідроксидів у надлишку розчину HCl; у надлишку розчину KOH.
12. Чому вологий оксид срібла (І) зафарбовує фенолфталеїн у рожевий колір?
13. Яке середовище водних розчинів AgNO3, Cu(NO3)2 та K[Au(OH)4]? Напишіть рівняння відповідних реакцій.
14. Закінчіть рівняння реакцій, розставте коефіцієнти:
а) 
б) 
в) 
г) 
ґ) 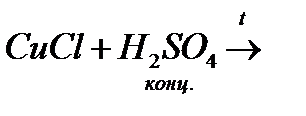
д) 
е) 
є) 
ж) 
з) 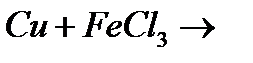
и) 
і) 
ї) 
й) 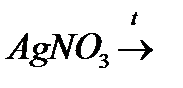
к) 
л) 
м) 
н) 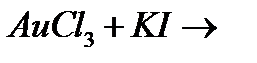
о) 
п) 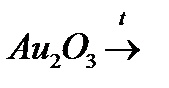
15. Напишіть рівняння реакцій, за допомоги яких можна здійснити наступні перетворення:
а) 
б) 
в) 
г) 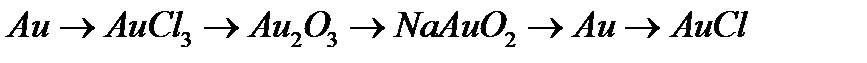 .
.
d-Елементи ІІ групи
1. Охарактеризуйте будову атомів d-елементів ІІ групи. Які їх електронні конфігурації в основному та збудженому станах? До яких електронних родин можна віднести дані елементи і чому?
2. Проаналізуйте характер зміни атомних радіусів, енергій іонізації, спорідненості до електрона, електронегативності атомів в ряду Zn-Hg. Чим обумовлена немонотонність зміни вказаних атомних характеристик? Чому радіус атома цинку (Z=30) менше атомного радіусу кальцію (Z=20)?
3. Які орбіталі в атомах розглянутих вище елементів можуть приймати участь в утворенні хімічних зв’язків? Які типи зв’язків характерні для Zn, Cd, Hg в їх сполуках?
4. Які значення валентності і які ступені окиснення характерні для вказаних елементів? Як можна пояснити, чому вони не проявляють ступенів окиснення більше +2? Чому дорівнюють валентність та ступінь окиснення ртуті в іонах (Hg2)2+ і (Hg3)2+?
5. Як змінюються відновлювальні (металічні) властивості простих речовин в ряду Zn-Hg? Які загальні хімічні властивості цих металів і в чому їх відмінність? Охарактеризуйте відношення металів до води, розчинів кислот, лугів та солей, напишіть рівняння відповідних реакцій.
6. Чому так сильно відрізняються значення стандартних електродних потенціалів міді і цинку, хоча в таблиці періодичної системи елементи Cu і Zn розташовані поруч?
7. Як змінюються кислотно-основні та окисно-відновні властивості оксидів і гідроксидів в ряду Zn-Hg? Напишіть рівняння реакцій, що характеризують амфотерні властивості оксиду та гідроксиду цинку.
8. Як змінюється термічна стійкість оксидів, гідроксидів та солей кисневмісних кислот в ряду Zn-Hg? Напишіть рівняння реакцій, що протікають при додаванні надлишку розчину NaOH до розчину Hg(NO3)2 і до розчину Hg2(NO3)2.
9. Напишіть рівняння реакцій термічного розкладання Hg(NO3)2; Hg2(NO3)2; HgSO4.
10. Напишіть рівняння реакцій взаємодії оксиду ртуті (ІІ) з йодидом калію у водному розчині. Назвіть отриману сполуку.
11. У чому полягає особливість електролітичної дисоціації галогенідів цинку, кадмію та ртуті (ІІ)? Чому електропровідність розчину HgCl2 є досить низькою навіть у розбавлених розчинах?
12. Як і чому змінюється ступінь гідролізу нітратів цинку, кадмію та ртуті (ІІ) у розчинах з їх однаковими концентраціями? Чому при приготуванні розчину Hg(NO3)2 рекомендується вносити сіль у заздалегідь підкислену воду? Напишіть рівняння відповідних реакцій гідролізу.
13. Закінчити рівняння реакцій, розставити коефіцієнти:
а) 
б) 
в) 
г) 
ґ) 
д) 
е) 
є) 
ж) 
з) 
и) 
і) 
ї) 
й) 
к) 
л) 
м) 
н) 
о) 
п) 
р) 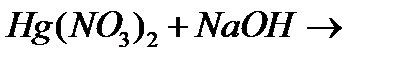
с) 
14. Напишіть рівняння реакцій, за допомоги яких можна здійснити наступні перетворення:
а) 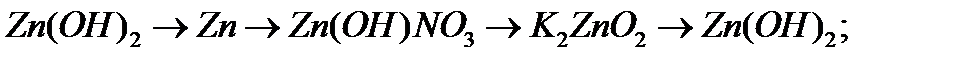
б) 
в) 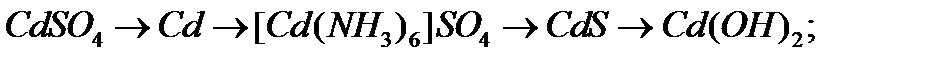
г)  .
.
d-елементи VII групи
1. Які ступені окиснення характерні для d-елементів VII групи? Наведіть по два приклади сполук цих елементів у характерних ступенях окиснення і назвіть їх.
2. Наведіть приклади катіонної та аніонної форм сполук марганцю (ІІІ) та марганцю (IV).
3. Напишіть рівняння реакцій, в яких сполуки марганцю проявляють: а) окиснювальні; б) відновлювальні властивості; в) окиснювальні та відновлювальні одночасно. Які сполуки марганцю можуть проявляти окиснювально-відновлювальну подвійність?
4.Охарактеризуйте положення Mn, Tc, Re в ряду напруг та їх відношення до води, кислот, лугів.
5. Проаналізуйте кислотно-основні властивості гідроксидів (оксидів) марганцю (ІІ, IV, VII).
6. Розгляньте окиснювальні властивості KMnO4 у різних середовищах. Що представляють собою продукти відновлення KMnO4 у кислих, нейтральних та лужних середовищах? Як змінюється забарвлення розчинів в процесі відновлення KMnO4?
7. Охарактеризуйте взаємодію хлоридної кислоти з оксидами марганцю MnO, MnO2, Mn2O7.
8. Що більше гідролізується:
а) MnCl2 або MnCl4;
б) K2MnO4 або KMnO4.
9. Напишіть рівняння реакцій, за допомоги яких можна здійснити перетворення:
а) 
б) 
в) 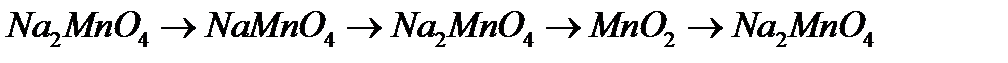 .
.
10. Закінчіть рівняння реакцій, вкажіть окисник, відновник і тип окисно-відновної реакції:
а) 
б) 
в) 
г) 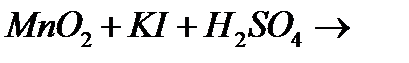
ґ) 
д) 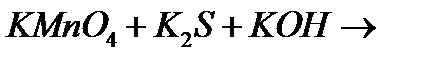
е) 
є) 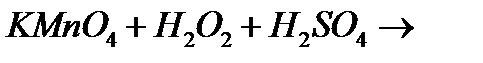
ж) 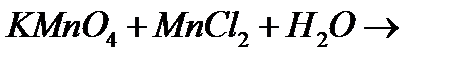
з) 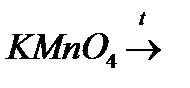
и) 
d-елементи VI групи
1. Які ступені окиснення характерні для d-елементів VI групи? Наведіть по два приклади сполук цих елементів у характерних ступенях окиснення та назвіть їх.
2. Порівняйте електронну структуру атомів хрому та сірки. Які ступені окиснення реалізуються для цих елементів? У якій ступені окиснення ці елементи проявляють схожість у властивостях?
3. Які оксиди утворюються при прожарюванні хрому, молібдену та вольфраму на повітрі?
4. Охарактеризуйте відношення хрому, молібдену та вольфраму до води, кислот та лугів. Чому хром не розчиняється у воді, хоча 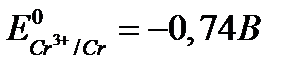 ?
?
5. Як змінюються кислотно-основні властивості оксидів в ряду CrO-CrO3? Наведіть реакції, що вказують на амфотерність гідроксиду хрому (ІІІ). Як взаємодіють оксиди хрому (ІІ, ІІІ, VI) з хлоридною та сульфатною кислотами?
6. Як змінюються властивості в ряду H2CrO4-H2WO4?
7. Напишіть рівняння гідролізу Cr2(SO4)3 за першою та другою ступенями. Яких умов необхідно дотримуватись при приготуванні розчинів солей Cr3+, щоб зменшити гідроліз за катіоном? Чи можливо отримати у водних розчинах Cr2S3?
8. Напишіть рівняння реакцій, за допомоги яких можна здійснити перетворення:
а)  ;
;
б) 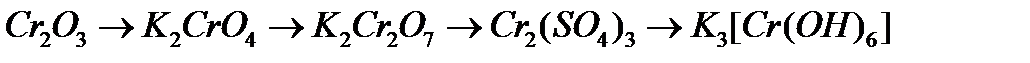 ;
;
в) 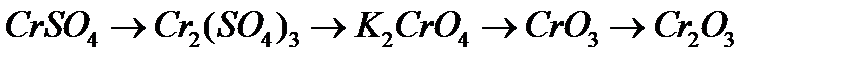 .
.
9. Закінчіть рівняння відповідних реакцій:
а) 
б) 
в) 
г) 
ґ) 
д) 
е) 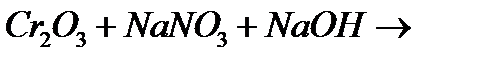
є) 
ж) 
з) 
и) 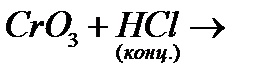
і) 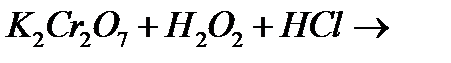
Дата добавления: 2015-10-26; просмотров: 107 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Отримання малорозчинних солей міді (ІІ). | | | ЗАДАЧІ І ВПРАВИ ДЛЯ САМОСТІЙНОЇ РОБОТИ |